题目内容
实验室常用过氧化氢溶液制取氧气.某同学取2g二氧化锰于锥形瓶中,然后慢慢滴入34g过氧化氢溶液,完全反应后,称得锥形瓶内剩余物质的总质量为34.4g.求:(1)生成氧气的质量为______g.
(2)该同学所用的过氧化氢溶液中发生反应的过氧化氢的质量.
【答案】分析:根据锥形瓶内质量的减少量就是生成的氧气的质量,根据氧气的质量依据反应的方程式可求出过氧化氢的质量;
解答:解:根据质量守恒定律可知氧气的质量是:34g+2g-34.4g=1.6g
设要生成1.6g氧气需要参加反应的过氧化氢的质量为X,则:
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
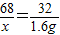
解得x=3.4g
故答案为:(1)1.6;(2)发生反应的过氧化氢的质量是3.4g;
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氧气的质量.
解答:解:根据质量守恒定律可知氧气的质量是:34g+2g-34.4g=1.6g
设要生成1.6g氧气需要参加反应的过氧化氢的质量为X,则:
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
x 1.6g
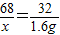
解得x=3.4g
故答案为:(1)1.6;(2)发生反应的过氧化氢的质量是3.4g;
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氧气的质量.

练习册系列答案
相关题目