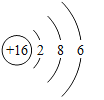题目内容
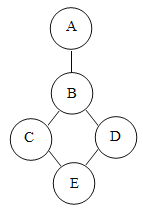
【题目】氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取![]() 。因为粗盐中含有杂质
。因为粗盐中含有杂质![]() 、泥沙等,必须经过提纯才能使用。
、泥沙等,必须经过提纯才能使用。
A 某兴趣小组进行粗盐提纯实验,步骤见下图:
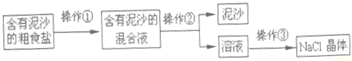
(1)操作②名称是_____,该操作中用玻璃棒引流时,玻璃棒下端靠在_____处;
(2)操作③蒸发,如果蒸发皿中的液滴飞溅,应采取的措施是_____;
(3)提纯实验前,称取![]() 粗盐,将该粗盐逐渐加入盛有
粗盐,将该粗盐逐渐加入盛有![]() 水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为
水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为![]() ,最终得到
,最终得到![]() 晶体
晶体![]() ,该实验精盐的产率是_____。
,该实验精盐的产率是_____。
(4)经过上述方法得到的氯化钠晶体为_____(填“混合物”或“纯净物”)
B 提纯时常用下列操作步骤:
①用稍过量的![]() 除去
除去![]() ;
;
②过滤;
③用稍过量的![]() 除去
除去![]() ;
;
④用稍过量的![]() 除去
除去![]()
⑤用稍过量的![]() 除去
除去![]() 等。则:
等。则:
(1)正确的操作顺序为_____(填序号)。
(2)加入![]() 溶液,其目的之一是除去
溶液,其目的之一是除去![]() ,还有一个目的,其反应的化学方程式为_____。
,还有一个目的,其反应的化学方程式为_____。
【答案】过滤 三层滤纸 用玻璃棒搅拌或移开酒精灯 80% 混合物 ③⑤④②① BaCl2+Na2CO3=BaCO3↓+2NaCl
【解析】
A、(1)操作②是将固体和液体分离,是过滤操作,该操作中玻璃棒的目的是引流,玻璃棒下端应靠在三层滤纸一侧;
(2)操作③蒸发,如果蒸发皿中的液滴飞溅,应采取的措施是用玻璃棒搅拌或移开酒精灯;
(3)称取![]() 粗盐,将该粗盐逐渐加入盛有
粗盐,将该粗盐逐渐加入盛有![]() 水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为
水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为![]() ,则溶解的粗盐质量为8g,最终得到
,则溶解的粗盐质量为8g,最终得到![]() 晶体
晶体![]() ,该实验精盐的产率是
,该实验精盐的产率是![]() ;
;
(4)因为粗盐中含有杂质![]() 、泥沙等,经过溶解过滤,只能除去泥沙,再蒸发后得到的晶体是混合物。
、泥沙等,经过溶解过滤,只能除去泥沙,再蒸发后得到的晶体是混合物。
B、(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将除去MgCl2;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将除去Na2SO4;至于先除氯化镁,还是先除硫酸钠都行,钙离子用碳酸根离子沉淀,除氯化钙加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡;离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为③⑤④②①;
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还有一个目的是除去多余的氯化钡,其反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl.

【题目】善于梳理化学知识,能使你更好地掌握知识。对某一主题知识进行归纳完全正确的是( )
A.材料知识 | B.化学与农业 |
①钢筋混凝土和玻璃钢:复合材料 ②黄铜和不锈钢:金属材料 ③涤纶和塑料:有机合成材料 | ①氮肥:使作物枝叶繁茂,叶色浓绿 ②钾肥:增强作物抗病和抗倒伏能力 ③磷肥:增强作物耐寒耐旱能力 |
C.化学符号与其表示意义 | D.安全常识 |
①氧化镁中镁元素的化合价: ② ③一个钙离子: | ①稀释浓硫酸:水倒入浓硫酸中 ②煤气泄露:严禁火种 ③菜窖取菜:须做灯火实验 ④减少酸雨:使用新型能源 |
A. AB. BC. CD. D