题目内容
如图是实验室制取气体的常用装置,请回答下列问题:
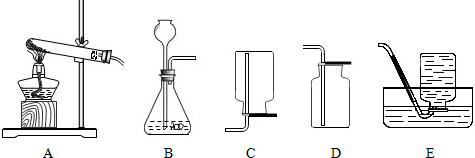
(1)写出一个制取氧气的化学方程式
(2)用装置制取氧气时,试管口为什么要略向下倾斜?
(3)实验室里,我们常用锌和稀硫酸反应来制取氢气,反应的化学方程式为 ;制取氢气时,应选用的发生装置是和收集装置是
(4)若采用B和D装置制取了一种气体,请简述验证该气体的实验方法.
(5)12.5g大理石与稀盐酸完全反应后,可生成二氧化碳气体4.4g,请计算大理石中杂质的质量分数.

(1)写出一个制取氧气的化学方程式
(2)用装置制取氧气时,试管口为什么要略向下倾斜?
(3)实验室里,我们常用锌和稀硫酸反应来制取氢气,反应的化学方程式为
(4)若采用B和D装置制取了一种气体,请简述验证该气体的实验方法.
(5)12.5g大理石与稀盐酸完全反应后,可生成二氧化碳气体4.4g,请计算大理石中杂质的质量分数.
考点:常用气体的发生装置和收集装置与选取方法,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,氢气的制取和检验,根据化学反应方程式的计算
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)实验室制取氧气可用加热高锰酸钾、氯酸钾和二氧化锰的混合物,或常温分解过氧化氢和二氧化锰混合物的方法;
(2)给试管中的固体药品加热,试管口向下倾斜是为了防止冷凝水倒流引起试管炸裂;
(3)据反应原理书写方程式,该反应不需加热,属于固体和液体常温下进行的反应,氢气密度比空气大、不溶于水,据此分析解答;
(4)B装置适用于固体和液体常温制取气体,D装置可收集密度大于空气的气体;
(5)据大理石与稀盐酸反应方程式,依据二氧化碳气体的质量计算碳酸钙的质量,并进而求出大理石中杂质的质量分数.
(2)给试管中的固体药品加热,试管口向下倾斜是为了防止冷凝水倒流引起试管炸裂;
(3)据反应原理书写方程式,该反应不需加热,属于固体和液体常温下进行的反应,氢气密度比空气大、不溶于水,据此分析解答;
(4)B装置适用于固体和液体常温制取气体,D装置可收集密度大于空气的气体;
(5)据大理石与稀盐酸反应方程式,依据二氧化碳气体的质量计算碳酸钙的质量,并进而求出大理石中杂质的质量分数.
解答:解:(1)实验室制取氧气可用加热高锰酸钾、氯酸钾和二氧化锰的混合物,或常温分解过氧化氢和二氧化锰混合物的方法,方程式分别是:2KMnO4
K2MnO4+MnO2+O2↑、2KClO3
2KCl+3O2↑、2H2O2
2H2O+O2↑;
(2)给试管中的固体药品加热,试管口向下倾斜是为了防止冷凝水倒流引起试管炸裂;
(3)实验室用锌和稀硫酸制取氢气,同时生成硫酸锌,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;该反应不需加热,属于固体和液体常温下进行的反应,故选发生装置B,氢气密度比空气大、不溶于水,所以可用向下排空气法或排水法收集;
(4)B装置适用于固体和液体常温制取气体,实验室制取氧气、二氧化碳、氢气均可用此发生装置,D装置可收集密度大于空气的气体,可收集氧气或二氧化碳;要检验气体是否是氧气或二氧化碳,可用带火星的木条伸入集气瓶观察是否复燃进行判断,也可向集气瓶内倒入澄清的石灰水观察是否变浑浊进行区分;
(5)设大理石中CaCO3 的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
=
x=10g
×100%=20%
答:大理石中杂质的质量分数为20%;
故答案为:(1)2KMnO4
K2MnO4+MnO2+O2↑(或2H2O2
2H2O+O2↑或2KClO3
2KCl+3O2↑);
(2)防止试管口的冷凝水回流到热的试管底部,炸裂试管;
(3)Zn+H2SO4═ZnSO4+H2↑;BC(或BE);
(4)将带火星的木条伸入D装置的集气瓶中,木条复燃,证明制取的气体是氧气(合理均可);
(5)大理石中杂质的质量分数为20%.
| ||
| ||
| △ |
| ||
(2)给试管中的固体药品加热,试管口向下倾斜是为了防止冷凝水倒流引起试管炸裂;
(3)实验室用锌和稀硫酸制取氢气,同时生成硫酸锌,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;该反应不需加热,属于固体和液体常温下进行的反应,故选发生装置B,氢气密度比空气大、不溶于水,所以可用向下排空气法或排水法收集;
(4)B装置适用于固体和液体常温制取气体,实验室制取氧气、二氧化碳、氢气均可用此发生装置,D装置可收集密度大于空气的气体,可收集氧气或二氧化碳;要检验气体是否是氧气或二氧化碳,可用带火星的木条伸入集气瓶观察是否复燃进行判断,也可向集气瓶内倒入澄清的石灰水观察是否变浑浊进行区分;
(5)设大理石中CaCO3 的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g
| 12.5g-10g |
| 12.5g |
答:大理石中杂质的质量分数为20%;
故答案为:(1)2KMnO4
| ||
| ||
| ||
| △ |
(2)防止试管口的冷凝水回流到热的试管底部,炸裂试管;
(3)Zn+H2SO4═ZnSO4+H2↑;BC(或BE);
(4)将带火星的木条伸入D装置的集气瓶中,木条复燃,证明制取的气体是氧气(合理均可);
(5)大理石中杂质的质量分数为20%.
点评:本题考查知识综合而全面,既考查了实验室制取气体的思路及理解应用,又考查了实验室制取气体的反应方程式和方程式计算等内容,能很好的考查学生应用知识解决问题 的能力.

练习册系列答案
相关题目
 如图所示的是甲、乙两种物质的溶解度曲线图.根据图中的相关信息判断,下列说法正确的是( )
如图所示的是甲、乙两种物质的溶解度曲线图.根据图中的相关信息判断,下列说法正确的是( )| A、降低温度可使接近饱和的甲溶液变为饱和 |
| B、甲、乙的溶解度相等 |
| C、40℃时,70g水最多可溶解乙30g,形成100g的饱和溶液 |
| D、30℃时,甲、乙饱和溶液中所含溶质质量一定相等 |
缓慢氧化是氧化反应的一种,也属于化学反应,请判断下列不属于缓慢氧化的是( )
| A、动植物的呼吸作用 |
| B、馒头发霉 |
| C、煤的燃烧 |
| D、醋和酒的酿造 |
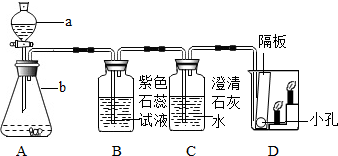
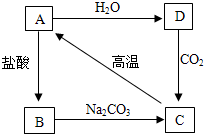 近年来,世界各地地震频发,造成了很大的人员伤亡和财产损失.结合下图含钙化合物间的相互转化关系,回答下列问题:
近年来,世界各地地震频发,造成了很大的人员伤亡和财产损失.结合下图含钙化合物间的相互转化关系,回答下列问题: