题目内容
【题目】某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是g.
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(3)根据实验数据,在右边的坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线.(不要求写出计算过程,只画出曲线即可)
【答案】
(1)1.8g.
(2)解:前二次反应后,每次生成气体的质量都是1.8g,第四次反应没有气体生成,故可判断第三次反应已完全.故生成气体的质量为158g+75g-228.6g=4.4g
设参与反应的Na2CO3的质量为x,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g![]() =
=![]() ,
,
解之得:x=10.6g,
产品中碳酸钠的质量分数为:![]() ×100%≈96.4%≥96%;
×100%≈96.4%≥96%;
故该产品中碳酸钠的质量分数合格.
(3)解: 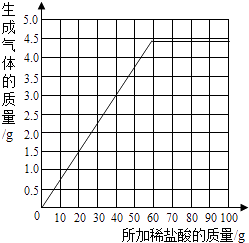
【解析】解:(1)第一次的结果中,二氧化碳的质量为158.0g+100g÷4﹣181.2g=1.8g;
(2)前二次反应后,每次生成气体的质量都是1.8g,第四次反应没有气体生成,故可判断第三次反应已完全.故生成气体的质量为158g+75g-228.6g=4.4g
设参与反应的Na2CO3的质量为x,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g![]() =
=![]() ,
,
解之得:x=10.6g,
产品中碳酸钠的质量分数为:![]() ×100%≈96.4%≥96%;
×100%≈96.4%≥96%;
答:该产品中碳酸钠的质量分数合格.
(3)根据前两步可以计算出当碳酸钠存在的情况下,每25g盐酸对应的二氧化碳质量为1.8g,当生成4.4g二氧化碳时,消耗的盐酸溶液的质量为61g.之后再加盐酸无气体生成.而开始时,盐酸为零,二氧化碳也为零.所以得图:

所以答案是:(1)1.8g;(2)合格;(3)见解析.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案