题目内容
【题目】铷是制造导弹合金材料的重要元素,某些信息如图所示,下列说法正确的是( )
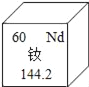
A. 铷元素符号是Nd,属于非金属元素
B. 铷元素的核外电子数是144.2
C. 铷原子核内有60个中子
D. 铷元素的原子序数为60
【答案】C
【解析】根据元素在元素周期表中的信息及质子数=电子数=核电荷数=原子序数解答。
A. 根据溴元素在周期表中的所提供的信息可知,铷元素符号是Nd,正确。根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,所以铷元素属于金属元素。故选项错误;
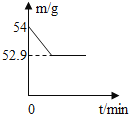
B. 根据溴元素在周期表中的所提供的信息可知:溴元素的相对原子质量为:144.2
,故选项错误;
C. 根据铷元素在周期表中的所提供的信息可知:铷元素是第60号元素。故有60个质子。又相对原子质量是144.2。根据相对原子质量=质子数+中子数可知,中子数约为80,故选项错误;
D. 根据铷元素在周期表中的所提供的信息可知:铷元素是第60号元素。故选项正确。

 名校课堂系列答案
名校课堂系列答案【题目】实验室需要配置不同浓度的氯化钠溶液,以备后续实验使用,主要步骤如下:
(1)查阅氯化钠的溶解度。下表是不同温度下氯化钠的溶解度,在![]() 时,所能的氯化钠溶液的最大浓度(溶质质量分数)是___________。(结果保留一位小数)
时,所能的氯化钠溶液的最大浓度(溶质质量分数)是___________。(结果保留一位小数)
温度/ | 0 | 10 | 20 | 30 | 40 | 50 |
| 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(2)计算: ![]() 时,溶质质量分数为20%的氯化钠溶液密度约为1.1
时,溶质质量分数为20%的氯化钠溶液密度约为1.1![]() 。欲配制100g溶液,需氯化钠的质量是____________g。
。欲配制100g溶液,需氯化钠的质量是____________g。
(3)称量:准确称量氯化钠固体。
(4)量取:用_____________(填“50mL”或“100mL”或“500mL”)量筒量取蒸馏水。(水的密度为1g/mL)
(5)溶解:将氯化钠和蒸馏水分别加入_________中(填仪器名称),用玻璃棒搅拌,使氯化钠完全溶解。
(6)装瓶贴标签。
(7)稀释:从上步骤配制的氯化钠溶液中去除50mL,加入一定量的水稀释,能够得到溶质质量分数11%的氯化钠溶液的质量为___________g。