题目内容
【题目】现有一包由6.4g铜粉和6.5g的锌粉混合而成的粉末,将它加入到一定量的AgNO3溶液中,完全反应后得到的金属为a种,溶液中的溶质为b种.关于该实验,有下列几种说法: ①若a=1,则b=2;②反应后金属的质量不可能超过21.6g
③a+b可能大于4; ④当得到的金属为20g时,a一定等于3.
以下说法正确的个数是( )
A.1
B.2
C.3
D.4
【答案】A
【解析】解:由金属活动性顺序表可知,金属的活动性Zn>Cu>Ag,向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,Zn首先与硝酸银溶液反应,Zn反应完成时,Cu再与硝酸银反应.化学方程式为:①Zn+2AgNO3=2Ag+Zn(NO3)2;②Cu+2AgNO3=2Ag+Cu(NO3)2 , ①当a=1时,则得到的金属为银,Cu和Zn全部反应,硝酸银溶液足量,恰好反应时,溶液中的溶质为硝酸铜和硝酸锌;硝酸银过量时,溶液中的溶质为硝酸铜、硝酸锌和硝酸银,因此b=2或b=3,故错误;②当上述两个反应恰好进行完全时,得到的金属的量最大, 设生成银的质量分别为x,y
Zn+2AgNO3= | 2Ag+Zn(NO3)2 | Cu+2AgNO3= | 2Ag+Cu(NO3)2 |
65 | 216 | 64 | 216 |
6.5g | x | 6.4g | y |
![]() =
= ![]()
![]() =
= ![]()
x=21.6g
y=21.6g
因此,反应后金属的质量不可能超过21.6g+21.6g=43.2g,故错误;③由A可知,a=1时,b最大为3,a+b=4;当硝酸银极少时,①反应未进行完,Zn有剩余,则金属为Zn、Cu、Ag,溶液中的溶质为硝酸锌,a=3,b=1,a+b=4,故错误;④当Zn恰好反应时,得到银为21.6g,当得到的金属质量为20克时,Zn有剩余,①反应未进行完,则金属为Zn、Cu、Ag,a=3,故正确.
故选:A.
【考点精析】关于本题考查的金属材料的选择依据和根据化学反应方程式的计算,需要了解黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
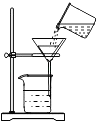
同步奥数系列答案【题目】甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应.甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳. 某化学小组为验证甲烷的组成,设计了如图所示实验. 该实验装置气密性良好,实验中所用试剂均足量.
已知装置 B、C、D、E中分别盛有浓硫酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色.
(1 )实验步骤:
Ⅰ.通人甲烷气体.
Ⅱ.点燃酒精灯加热,反应一段时间后,停止加热.
Ⅲ.继续通甲烷至玻璃管冷却.
(2 )有关现象:
①A中黑色固体变红色;②C中未见变蓝色;③E中未见出现浑浊.
(3 )有关数据:
A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
反应前 | 108.0 | 212.0 | 131.0 |
反应后 | 106.4 | 212.9 | 132.1 |
请回答下列问题:
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与相同.
A.用石灰石与稀盐酸制二氧化碳
B.用过氧化氢制氧气
C.用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为 .
(3)实验过程中通入甲烷的作用各不相同.步骤Ⅰ是; 步骤Ⅱ是还原氧化铜;步骤Ⅲ是 .
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素.相关计算式为 .