题目内容
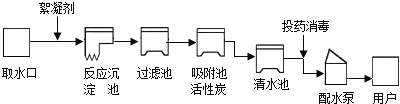
【题目】新型材料纳米级Fe粉具有广泛的用途,它比普通Fe粉更易与氧气反应,其制备工艺流程如下图所示:
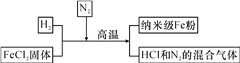
请回答下列问题:
(1)纳米级Fe粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为________。
(2)请补充完成上述制备工艺的化学方程式:________________________________。在制备纳米级Fe粉的工艺流程中,N2的作用是________________________,该作用利用了氮气的________(填“物理”或“化学”)性质。
(3)研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质。为除去样品中的杂质,在无氧环境下,先溶解,然后再________、________、干燥。
【答案】 Fe3O4 FeCl2+H2![]() Fe+2HCl 防止纳米级Fe粉被氧化(或作保护气) 化学 过滤 洗涤
Fe+2HCl 防止纳米级Fe粉被氧化(或作保护气) 化学 过滤 洗涤
【解析】(1)纳米级Fe粉在氧气中能自发燃烧,铁燃烧产物为四氧化三铁,此黑色固体是四氧化三铁,化学式为Fe3O4 。(2)由题中信息可知,氯化亚铁和氢气在高温条件下生成氯化氢和铁,化学方程式:FeCl2+H2![]() Fe+2HCl。在制备纳米级Fe粉的工艺流程中,N2的作用是隔绝氧气防止铁和空气中的氧气反应;该作用利用了氮气的化学性质稳定。(3)Fe粉样品中混有少量的FeCl2杂质。为除去样品中的杂质,在无氧环境下,由于铁粉是不溶于水的固体,氯化亚铁是可溶性物质,所以可先溶解,然后再过滤、洗涤、干燥。
Fe+2HCl。在制备纳米级Fe粉的工艺流程中,N2的作用是隔绝氧气防止铁和空气中的氧气反应;该作用利用了氮气的化学性质稳定。(3)Fe粉样品中混有少量的FeCl2杂质。为除去样品中的杂质,在无氧环境下,由于铁粉是不溶于水的固体,氯化亚铁是可溶性物质,所以可先溶解,然后再过滤、洗涤、干燥。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】下列有关规范实验操作的叙述不正确( )
A. 严禁未经清洗的滴管再吸取其它试剂
B. 禁止向正燃着的酒精灯里添加酒精
C. 不得用手接触药品,更不得品尝任何药品的味道
D. 实验用剩余的药品要放回原瓶
【题目】空气是人类最宝贵的自然资源。其中氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程.请按要求回答下列问题: 
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气。
(2)写出步骤②中发生反应的化学式表达式____________ 。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是___(填字母)。
A.易溶于水 B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
【查找资料】①碱石灰能够吸收水和CO2,但是不吸收NH3
②浓硫酸能吸收NH3但是不吸收CO2
③氨气溶于水形成氨水

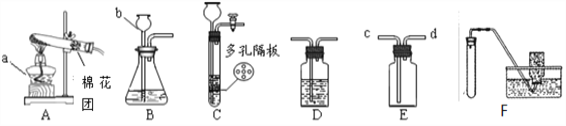
【性质探究】该同学设计了如下的实验装置:
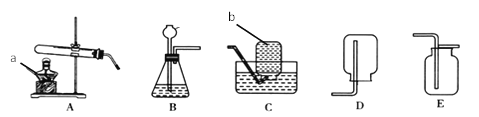
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是_________。
②取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是_____ 。
③连接A、B装置,继续加热,观察到试管口的现象是______,B中的现象是______。
④碳酸氢铵在受热时发生反应的化学式表达式是 __________ 。
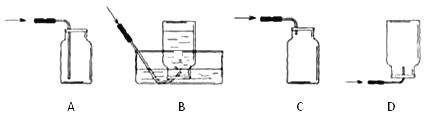
【含量分析】将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
⑤由此分析得知:反应中产生氨气的质量为_______ g。
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为______ 。
⑦请计算此化肥中碳酸氢铵的纯度_______ 。