题目内容
 生活中处处有化学.
生活中处处有化学.(1)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙中氯元素的化合价为 价.
(2)干冰可用于人工降雨,主要是因为 .
(3)①右表为“新盖中盖”产品的部分说明. ①该产品的保健功能是“补钙”,这里的“钙”是指 (填字母序号).
A.钙原子 B.钙元素 C.碳酸钙 D.钙单质
②根据说明计算,每片高钙片中含碳酸钙的质量分数是
(4)热水壶中沉积的水垢主要成分为氢氧化镁和碳酸钙,用食醋(含醋酸CH3COOH)可以除去水垢,其中与氢氧化镁反应的化学方程式为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O,则醋酸与碳酸钙反应的化学方程式为 .
【答案】分析:(1)根据在化合物中正负化合价代数和为零,结合次氯酸钙Ca(ClO)2的化学式进行分析解答本题.
(2)根据干冰升华吸热进行分析;
(3)①食品、药品、营养品、矿泉水等物质中的“钙”等不是以单质、氧化物、分子、原子等形式存在,而是指元素;②由题意,每片含钙元素500mg=0.5g,根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合题意进行分析解答.
(4)根据题中信息可知醋酸具有酸的性质,据此写出反应的化学方程式.
解答:解:(1)根据在化合物中正负化合价代数和为零,钙元素显+2,氧元素显-2,设氯元素的化合价是x,可知次氯酸钙Ca(ClO)2中氯元素的化合价:(+2)+2x+(-2)×2=0,则x=+1.
故答案为:+1;
(2)干冰升华吸热,因此干冰可用于人工降雨.
故答案为:易升华吸热;
(3)①“新盖中盖牌”高钙片中的“钙”不是以单质、氧化物、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关;
②CaCO3的相对分子质量=40+12+16×3=100;
CaCO3中钙元素的质量分数=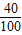 ×100%=40%;
×100%=40%;
每片高钙片中含CaCO3的质量=0.5g÷40%=1.25g;
高钙片中碳酸钙的质量分数=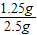 ×100%=50%.
×100%=50%.
故答案为:①B;②50%;
(4)醋酸与氢氧化镁反应的化学方程式:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O,可知醋酸具有酸的性质,因此醋酸与碳酸钙反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.
故答案案为:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.
点评:本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力以及二氧化碳的性质、元素的概念等.
(2)根据干冰升华吸热进行分析;
(3)①食品、药品、营养品、矿泉水等物质中的“钙”等不是以单质、氧化物、分子、原子等形式存在,而是指元素;②由题意,每片含钙元素500mg=0.5g,根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合题意进行分析解答.
(4)根据题中信息可知醋酸具有酸的性质,据此写出反应的化学方程式.
解答:解:(1)根据在化合物中正负化合价代数和为零,钙元素显+2,氧元素显-2,设氯元素的化合价是x,可知次氯酸钙Ca(ClO)2中氯元素的化合价:(+2)+2x+(-2)×2=0,则x=+1.
故答案为:+1;
(2)干冰升华吸热,因此干冰可用于人工降雨.
故答案为:易升华吸热;
(3)①“新盖中盖牌”高钙片中的“钙”不是以单质、氧化物、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关;
②CaCO3的相对分子质量=40+12+16×3=100;
CaCO3中钙元素的质量分数=
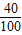 ×100%=40%;
×100%=40%;每片高钙片中含CaCO3的质量=0.5g÷40%=1.25g;
高钙片中碳酸钙的质量分数=
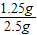 ×100%=50%.
×100%=50%.故答案为:①B;②50%;
(4)醋酸与氢氧化镁反应的化学方程式:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O,可知醋酸具有酸的性质,因此醋酸与碳酸钙反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.
故答案案为:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.
点评:本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力以及二氧化碳的性质、元素的概念等.

练习册系列答案
相关题目