题目内容
过氧化氢是一种化学性质不稳定的物质.实验室里现有一瓶久置的过氧化氢消毒液.为测定其溶质的质量分数,某化学活动小组的同学做了如下实验:称取2g二氧化锰放入烧杯中,加入100g该消毒液,反应完全后烧杯中剩余物质的总质量为98g,请计算该过氧化氢消毒液中溶质的质量分数.
解:①生成氧气的质量为:100g+2g-98g=4g;
②设参与反应的H2O2质量为x,
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
x 4g
根据: 解得x=8.5g;
解得x=8.5g;
该过氧化氢消毒液中溶质的质量分数为: ×100%=8.5%.
×100%=8.5%.
答:该过氧化氢消毒液中溶质的质量分数为8.5%.
分析:①过氧化氢分解反应中,二氧化锰只是催化剂,本身不参与反应.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成氧气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
②根据过氧化氢分解的化学方程式和生成的氧气的质量,列出比例式,就可计算出参与反应的H2O2质量,然后根据溶质质量分数=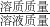 ×100%计算即可.
×100%计算即可.
点评:本题主要考查学生利用质量守恒定律、化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
②设参与反应的H2O2质量为x,
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
x 4g
根据:
 解得x=8.5g;
解得x=8.5g;该过氧化氢消毒液中溶质的质量分数为:
 ×100%=8.5%.
×100%=8.5%.答:该过氧化氢消毒液中溶质的质量分数为8.5%.
分析:①过氧化氢分解反应中,二氧化锰只是催化剂,本身不参与反应.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成氧气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
②根据过氧化氢分解的化学方程式和生成的氧气的质量,列出比例式,就可计算出参与反应的H2O2质量,然后根据溶质质量分数=
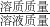 ×100%计算即可.
×100%计算即可.点评:本题主要考查学生利用质量守恒定律、化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目