题目内容
(2010?梅州)工业上用电解NaCl溶液的方法来制取NaOH、Cl2和H2,反应的化学方程式为:2NaCl+2H2O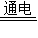 2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液214.6g进行电解,当NaCl完全反应时,生成0.4gH2.
2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液214.6g进行电解,当NaCl完全反应时,生成0.4gH2.(1)当NaCl完全反应时,生成Cl2的质量为______g,参加反应的NaCl的质量为______g.
(2)当NaCl完全反应时,所得NaOH溶液中溶质的质量分数为多少?(假设生成的Cl2和H2全部逸出)
【答案】分析:(1)根据题目中给出的化学方程式,利用生成的氢气质量可求出生成的氯气质量及参加反应的氯化钠的质量;
(2)同样根据方程式利用氢气质量,可求出反应生成的氢氧化钠的质量,然后用氢氧化钠的质量除以反应后溶液的质量可得到反应后溶质的质量分数.其中反应后溶液的质量=参加反应的固体质量+液体质量-反应生成的气体质量.
解答:解:(1)设NaCl完全反应时生成Cl2的质量为x,参加反应的NaCl的质量为y
2NaCl+2H2O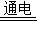 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
117 2 71
y 0.4g x
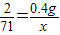 x=14.2g
x=14.2g
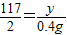 y=23.4g
y=23.4g
(2)设生成NaOH的质量为z.
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
80 2
z 0.4g
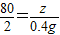 z=16g
z=16g
则NaOH的质量分数=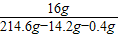 ×100%=8%
×100%=8%
答:(1)当NaCl完全反应时,生成Cl2的质量为14.2g,参加反应的NaCl的质量为23.4g;
(2)所得NaOH溶液中溶质的质量分数为8%.
点评:此题是溶质质量分数和化学方程式相结合的计算题,因为解题所用的化学方程式已经给出,使难度有所降低,此题重点是掌握住溶质质量分数的计算公式.
(2)同样根据方程式利用氢气质量,可求出反应生成的氢氧化钠的质量,然后用氢氧化钠的质量除以反应后溶液的质量可得到反应后溶质的质量分数.其中反应后溶液的质量=参加反应的固体质量+液体质量-反应生成的气体质量.
解答:解:(1)设NaCl完全反应时生成Cl2的质量为x,参加反应的NaCl的质量为y
2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑117 2 71
y 0.4g x
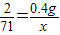 x=14.2g
x=14.2g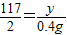 y=23.4g
y=23.4g (2)设生成NaOH的质量为z.
2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑80 2
z 0.4g
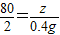 z=16g
z=16g则NaOH的质量分数=
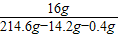 ×100%=8%
×100%=8%答:(1)当NaCl完全反应时,生成Cl2的质量为14.2g,参加反应的NaCl的质量为23.4g;
(2)所得NaOH溶液中溶质的质量分数为8%.
点评:此题是溶质质量分数和化学方程式相结合的计算题,因为解题所用的化学方程式已经给出,使难度有所降低,此题重点是掌握住溶质质量分数的计算公式.

练习册系列答案
相关题目
 2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液214.6g进行电解,当NaCl完全反应时,生成0.4gH2.
2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液214.6g进行电解,当NaCl完全反应时,生成0.4gH2. CO+H2,下列对该反应的认识错误的是( )
CO+H2,下列对该反应的认识错误的是( ) 2NaOH+Cl2↑+H2↑.因饱和食
2NaOH+Cl2↑+H2↑.因饱和食