题目内容
(2012?昭通)为了测定一瓶过氧化氢溶液的溶质质量分数,取17.0g过氧化氢溶液于烧杯中,加入0.2g二氧化锰,充分反应至烧杯中物质质量不再减轻,称量烧杯中剩余物质质量为16.8g,假设生成的气体全部逸出.
(1)根据质量守恒定律可知,生成氧气的质量为
(2)计算这瓶过氧化氢溶液中溶质的质量分数(计算结果精确到0.1%).
(1)根据质量守恒定律可知,生成氧气的质量为
0.4
0.4
g;(2)计算这瓶过氧化氢溶液中溶质的质量分数(计算结果精确到0.1%).
分析:(1)根据质量守恒定律,反应前后减少的质量为氧气的质量.
(2)利用分解过氧化氢制氧气的化学方程式,根据氧气的质量求出过氧化氢的质量,根据溶质质量分数的计算公式求出过氧化氢溶液中溶质的质量分数.
(2)利用分解过氧化氢制氧气的化学方程式,根据氧气的质量求出过氧化氢的质量,根据溶质质量分数的计算公式求出过氧化氢溶液中溶质的质量分数.
解答:解:(1)生成氧气的质量是17g+0.2g-16.8g=0.8g=0.4g
(2)设:该过氧化氢溶液中溶质的质量为x
2H2O2
2H2O+O2↑
68 32
x 0.4g
=
x=0.85g
过氧化氢溶液中溶质的质量分数=
×100%=5%
答:该过氧化氢溶液中溶质的质量分数是5%、
故答案为:(1)0.4g (2)5%
(2)设:该过氧化氢溶液中溶质的质量为x
2H2O2
| ||
68 32
x 0.4g
| 68 |
| 32 |
| x |
| 0.4g |
过氧化氢溶液中溶质的质量分数=
| 0.85g |
| 17g |
答:该过氧化氢溶液中溶质的质量分数是5%、
故答案为:(1)0.4g (2)5%
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氧气的质量

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 B、
B、 C、
C、 D、
D、
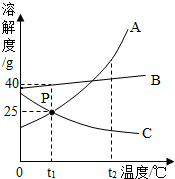 (2012?昭通)如图,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题.
(2012?昭通)如图,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题.