题目内容
(2007?海南)海南四周环海,海洋资源极为丰富,从海水中提取镁的第一步反应的化学方程式为MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2现有海水样品(含NaCl、lMgCl2、CaCl2)400g,加入足量澄清石灰水,充分反应后得沉淀1.16g,求海水中MgCl2的质量分数.
【答案】分析:由样品和生成沉淀质量根据化学方程式可以计算出海水中氯化镁的质量分数.
解答:解:设海水中氯化镁的质量分数为x.
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
95 58
400g×x 1.16g
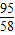 =
= ,x=0.475%
,x=0.475%
答:海水中MgCl2的质量分数为0.475%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
解答:解:设海水中氯化镁的质量分数为x.
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
95 58
400g×x 1.16g
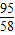 =
= ,x=0.475%
,x=0.475%答:海水中MgCl2的质量分数为0.475%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
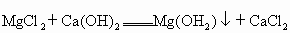 .现有海水样品(含NaCl、
.现有海水样品(含NaCl、 、
、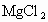 )400g,加足量石灰水,充分反应后得沉淀1.16g.求海水样品中
)400g,加足量石灰水,充分反应后得沉淀1.16g.求海水样品中 的质量分数.
的质量分数.