题目内容
一定质量的甲烷不完全燃烧时生成CO、CO2和H2O,已知产物的总质量为49.6g,其中有水25.2g.
求:
(1)参加反应的甲烷为多少克?
(2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式.
解:(1)求出水中氢元素的质量为:25.2g×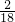 =2.8g,在甲烷中碳元素和氢元素的质量比为:12:4=3:1,所以甲烷氢元素的质量分数为:
=2.8g,在甲烷中碳元素和氢元素的质量比为:12:4=3:1,所以甲烷氢元素的质量分数为: ,因此甲烷的质量为2.8g÷
,因此甲烷的质量为2.8g÷ =11.2g.故答案:11.2g.
=11.2g.故答案:11.2g.
(2)设生成的一氧化碳、二氧化碳的质量分别为:x、y,则x+y=49.6g-25.2g=24.4g.
一氧化碳中碳元素的质量为: x,二氧化碳中碳元素的质量为:
x,二氧化碳中碳元素的质量为: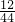 y
y
甲烷中碳元素的质量为11.2g×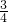 =8.4g,所以
=8.4g,所以 x+
x+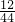 y=8.4g
y=8.4g
解得x=11.2g y=13.2g
答:生成的一氧化碳的质量为11.2g,生成的二氧化碳的质量为13.2g.
(3)反应生成的一氧化碳和二氧化碳的质量比为:11.2g:13.2g=28:33,设反应中生成的一氧化碳和二氧化碳的化学计量数分别为a、b,则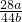 =
=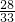 ,所以
,所以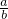 =
=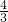 ,故答案:7CH4+12O2
,故答案:7CH4+12O2  4CO+3CO2+14H2O(1)11.2g
4CO+3CO2+14H2O(1)11.2g
(2)11.2g、13.2g
(3)7CH4+12O2 4CO+3CO2+14H2O
4CO+3CO2+14H2O
分析:(1)根据水的化学式求出水中氢元素的质量,根据反应前后元素质量守恒可知甲烷中氢元素的质量和生成的水中氢元素质量相等,可得出甲烷中氢元素的质量;再根据甲烷的化学式求出氢元素的质量分数,甲烷中氢元素质量除以甲烷中氢元素的质量分数即可求出甲烷的质量.
(2)设出生成的一氧化碳和二氧化碳的质量,二者质量和等于49.6g-25.2g=24.4g.然后结合一氧化碳中碳元素的质量和二氧化碳中碳元素的质量和等于甲烷中碳元素的质量即可解答.
(3)根据(2)中得数求出一氧化碳和二氧化碳的质量比,然后就可求出反应中一氧化碳和二氧化碳的化学计量数之比,就可写出甲烷燃烧的化学方程式.
点评:解答该题的关键是抓住化学反应前后元素质量守恒,依次为出发点一步一步计算即可解答.
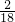 =2.8g,在甲烷中碳元素和氢元素的质量比为:12:4=3:1,所以甲烷氢元素的质量分数为:
=2.8g,在甲烷中碳元素和氢元素的质量比为:12:4=3:1,所以甲烷氢元素的质量分数为: ,因此甲烷的质量为2.8g÷
,因此甲烷的质量为2.8g÷ =11.2g.故答案:11.2g.
=11.2g.故答案:11.2g.(2)设生成的一氧化碳、二氧化碳的质量分别为:x、y,则x+y=49.6g-25.2g=24.4g.
一氧化碳中碳元素的质量为:
 x,二氧化碳中碳元素的质量为:
x,二氧化碳中碳元素的质量为: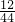 y
y甲烷中碳元素的质量为11.2g×
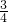 =8.4g,所以
=8.4g,所以 x+
x+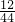 y=8.4g
y=8.4g解得x=11.2g y=13.2g
答:生成的一氧化碳的质量为11.2g,生成的二氧化碳的质量为13.2g.
(3)反应生成的一氧化碳和二氧化碳的质量比为:11.2g:13.2g=28:33,设反应中生成的一氧化碳和二氧化碳的化学计量数分别为a、b,则
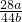 =
=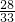 ,所以
,所以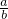 =
=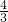 ,故答案:7CH4+12O2
,故答案:7CH4+12O2  4CO+3CO2+14H2O(1)11.2g
4CO+3CO2+14H2O(1)11.2g (2)11.2g、13.2g
(3)7CH4+12O2
 4CO+3CO2+14H2O
4CO+3CO2+14H2O分析:(1)根据水的化学式求出水中氢元素的质量,根据反应前后元素质量守恒可知甲烷中氢元素的质量和生成的水中氢元素质量相等,可得出甲烷中氢元素的质量;再根据甲烷的化学式求出氢元素的质量分数,甲烷中氢元素质量除以甲烷中氢元素的质量分数即可求出甲烷的质量.
(2)设出生成的一氧化碳和二氧化碳的质量,二者质量和等于49.6g-25.2g=24.4g.然后结合一氧化碳中碳元素的质量和二氧化碳中碳元素的质量和等于甲烷中碳元素的质量即可解答.
(3)根据(2)中得数求出一氧化碳和二氧化碳的质量比,然后就可求出反应中一氧化碳和二氧化碳的化学计量数之比,就可写出甲烷燃烧的化学方程式.
点评:解答该题的关键是抓住化学反应前后元素质量守恒,依次为出发点一步一步计算即可解答.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
一定质量的甲烷不完全燃烧时生成CO、CO2和H2O,已知产物的总质量为49.6g,其中有水25.2g.
求:
(1)参加反应的甲烷为多少克?
(2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式.
求:
(1)参加反应的甲烷为多少克?
(2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式.
一定质量的甲烷不完全燃烧时生成CO、CO2和H2O,已知产物的总质量为49.6g,其中有水25.2g.
求:
(1)参加反应的甲烷为多少克?
(2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式.
求:
(1)参加反应的甲烷为多少克?
(2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式.