题目内容
氨气是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,呈碱性.氨在化学工业上用途不仅很广泛,如制化肥和纯碱,而且近年来,氨还用于环境治理.
(1)在氨分子中,氮、氢元素质量比为______.
(2)“侯氏制碱法”关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3↓+A,其生成物A也可以作化肥,A物质的化学式是______,其氮元素质量分数为______.
(3)在400℃宅右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为氮气和水,试写出该反应的化学方程式______.
(4)在细菌的作用下,氨处理含甲醇的工业废水,使其变成无毒的物质,从而清除对环境的污染,有关方程式是:6NH3+5CH3OH+12B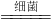 3N2+5CO2+19H20,上述反应的B处应填入的物质的化学式是______.
3N2+5CO2+19H20,上述反应的B处应填入的物质的化学式是______.
解:(1)在氨分子中,氮、氢元素质量比为14:(1×3)=14:3.
(2)根据反应的化学方程式NH3+CO2+H2O+NaCl=NaHCO3↓+A,反应物中氮、氢、碳、氧、钠、氯原子个数分别为1、5、1、3、1、1,反应后的生成物中氮、氢、碳、氧、钠、氯原子个数分别为0、1、1、3、1、0,根据反应前后原子种类、数目不变,则每个A分子由1个氮原子、4个氢原子和1个氯原子构成,则物质A的化学式为NH4Cl.其氮元素质量分数为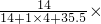 100%≈26.2%.
100%≈26.2%.
(3)在400℃宅右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为氮气和水,该反应的化学方程式为:4NH3+6NO 5N2+6H2O.
5N2+6H2O.
(4)根据反应的化学方程式6NH3+5CH3OH+12B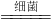 3N2+5CO2+19H20,反应物氮、氢、碳、氧原子个数分别为6、38、5、5,反应后的生成物中氮、氢、碳、氧原子个数分别为6、38、5、29,根据反应前后原子种类、数目不变,则12B中含有24个氧原子,则每B分子由2个氧原子构成,则物质B的化学式为O2.
3N2+5CO2+19H20,反应物氮、氢、碳、氧原子个数分别为6、38、5、5,反应后的生成物中氮、氢、碳、氧原子个数分别为6、38、5、29,根据反应前后原子种类、数目不变,则12B中含有24个氧原子,则每B分子由2个氧原子构成,则物质B的化学式为O2.
故答案为:(1)14:3;(2)NH4Cl;26.2%;(3)4NH3+6NO 5N2+6H2O;(4)O2.
5N2+6H2O;(4)O2.
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物A的化学式.
根据化合物中元素的质量分数=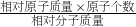 ×100%,进行分析解答.
×100%,进行分析解答.
(3)由题意,在400℃宅右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为氮气和水,写出该反应的化学方程式即可.
(4)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物B的化学式.
点评:本题难度不大,掌握化学式的有关计算、利用化学反应前原子守恒来确定物质的化学式的方法、化学方程式的书写是正确解题的关键.
(2)根据反应的化学方程式NH3+CO2+H2O+NaCl=NaHCO3↓+A,反应物中氮、氢、碳、氧、钠、氯原子个数分别为1、5、1、3、1、1,反应后的生成物中氮、氢、碳、氧、钠、氯原子个数分别为0、1、1、3、1、0,根据反应前后原子种类、数目不变,则每个A分子由1个氮原子、4个氢原子和1个氯原子构成,则物质A的化学式为NH4Cl.其氮元素质量分数为
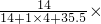 100%≈26.2%.
100%≈26.2%.(3)在400℃宅右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为氮气和水,该反应的化学方程式为:4NH3+6NO
 5N2+6H2O.
5N2+6H2O.(4)根据反应的化学方程式6NH3+5CH3OH+12B
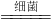 3N2+5CO2+19H20,反应物氮、氢、碳、氧原子个数分别为6、38、5、5,反应后的生成物中氮、氢、碳、氧原子个数分别为6、38、5、29,根据反应前后原子种类、数目不变,则12B中含有24个氧原子,则每B分子由2个氧原子构成,则物质B的化学式为O2.
3N2+5CO2+19H20,反应物氮、氢、碳、氧原子个数分别为6、38、5、5,反应后的生成物中氮、氢、碳、氧原子个数分别为6、38、5、29,根据反应前后原子种类、数目不变,则12B中含有24个氧原子,则每B分子由2个氧原子构成,则物质B的化学式为O2.故答案为:(1)14:3;(2)NH4Cl;26.2%;(3)4NH3+6NO
 5N2+6H2O;(4)O2.
5N2+6H2O;(4)O2.分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物A的化学式.
根据化合物中元素的质量分数=
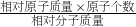 ×100%,进行分析解答.
×100%,进行分析解答.(3)由题意,在400℃宅右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为氮气和水,写出该反应的化学方程式即可.
(4)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物B的化学式.
点评:本题难度不大,掌握化学式的有关计算、利用化学反应前原子守恒来确定物质的化学式的方法、化学方程式的书写是正确解题的关键.

练习册系列答案
相关题目