题目内容
请结合下列实验常用装置,回答有关问题。
 |  | ||
A B C D E F
① 写出仪器a的名称: (1) 。
② 若用氯酸钾和二氧化锰制取氧气,该反应的化学方程式是 (2) ,二氧化锰在此反应中的作用是 (3) 。将装置A和D连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是 (4) 。
③ 若用块状石灰石和稀盐酸制取二氧化碳,选用的装置组合是 (5) (填字母编号),在加试剂之前的操作是 (6) 。将收集到的二氧化碳气体通入盛有蒸馏水的试管,一段时间后,测得该试管中溶液的pH (7) (填“>”、“<”或“=”)7,对该现象的合理解释为 (8) (用化学方程式表示)。
④ C O2
O2 CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (9) (写出 1条)。
CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (9) (写出 1条)。
⑤ 某同学用石灰石和稀盐酸完成“制取并检验CO2”的实验,消耗了73克10%的盐酸。计算实验过程中产生CO2的物质的量是多少? (10)
(1)长颈漏斗
(2)2KClO3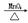 2KCl+3O2↑(3)催化作用(或加快反应速度)(4)防止水倒流造成试管破裂
2KCl+3O2↑(3)催化作用(或加快反应速度)(4)防止水倒流造成试管破裂
 (5)B E或CE(答一组不扣分) (6)检查装置气密性 (7)< (8)CO2+H2O H2CO3
(5)B E或CE(答一组不扣分) (6)检查装置气密性 (7)< (8)CO2+H2O H2CO3
(9)反应物中有气体参加,很难收集到纯净的二氧化碳(或燃烧条件下,很难将其控制在一个密闭的环境中进行,所以无法收集等)(其他合理也可)
(10)解:73g10%的盐酸中溶质为7.3g,物质的量为0.2mol (1分)
设实验过程中产生CO2的物质的量为xmol
 CaCO3+2HCl CaCl2+H2O+CO2↑ (1分)
CaCO3+2HCl CaCl2+H2O+CO2↑ (1分)
 2mol 1mol
2mol 1mol
0.2mol x
2:0.2= 1:x (1分)
解得x=0. 1mol (1分)
1mol (1分)
答:实验过程中产生CO2的物质的质为0.1mol。


 ,易溶于水,密度比空气大,常温下在空气中不发生反应.
,易溶于水,密度比空气大,常温下在空气中不发生反应.
 ,易溶于水,密度比空气大,常温下在空气中不发生反应.
,易溶于水,密度比空气大,常温下在空气中不发生反应.