题目内容
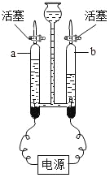
【题目】我们需要洁净的水源,自来水生产加入液氯的作用是______________。用如图实验验证水的组成,反应的化学方程式是______________。证明a管中气体的方法是______________,a和b管中气体的质量比是______________。该实验证明了水是由______________组成。0.5mol水中约含______________个氢原子。电解水过程中保持不变的微粒是_______________(填写微粒名称)
【答案】杀菌消毒  将带火星的木条置于管口,若复燃则为氧气 8:1 氢元素和氧元素 6.02×1023 氢原子和氧原子
将带火星的木条置于管口,若复燃则为氧气 8:1 氢元素和氧元素 6.02×1023 氢原子和氧原子
【解析】
自来水生产通入氯气的作用是杀菌消毒;水通电分解生成氢气和氧气,反应的化学方程式为: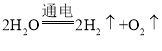 。a管气体少,所收集的气体是氧气,b管气体多,所收集的气体是氢气,因为氧气具有助燃性,可用带火星检验,能使带火星的木条复燃。仪器内水通直流电生成氢气和氧气,生成氢气和氧气的体积比是2:1,质量比为8:1,该反应是个分解反应,生成物中只有氢氧两种元素,根据反应前后元素守恒,即可证明水是由氢元素和氧元素组成的;0.5mol水中约含1mol氢原子,即6.02×1023个氢原子; 原子是化学变化中的最小微粒,即电解水中保持不变的是氢原子和氧原子。
。a管气体少,所收集的气体是氧气,b管气体多,所收集的气体是氢气,因为氧气具有助燃性,可用带火星检验,能使带火星的木条复燃。仪器内水通直流电生成氢气和氧气,生成氢气和氧气的体积比是2:1,质量比为8:1,该反应是个分解反应,生成物中只有氢氧两种元素,根据反应前后元素守恒,即可证明水是由氢元素和氧元素组成的;0.5mol水中约含1mol氢原子,即6.02×1023个氢原子; 原子是化学变化中的最小微粒,即电解水中保持不变的是氢原子和氧原子。
答案:杀菌消毒;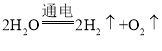 ;将带火星的木条置于管口,若复燃则为氧气;8:1;氢元素和氧元素;6.02×1023;氢原子和氧原子。
;将带火星的木条置于管口,若复燃则为氧气;8:1;氢元素和氧元素;6.02×1023;氢原子和氧原子。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】如图是两种固体的溶解度曲线。
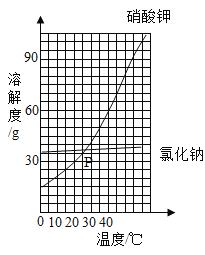
(1)40℃时,氯化钠的溶解度________(填“>”“=”或“<”)硝酸钾的溶解度;P点的含义是_________________。
(2)硝酸钾的溶解度随温度的升高而____________________。
(3)若将饱和的硝酸钾溶液从40℃降温到10℃_________(填“有”或“无”)晶体析出。
(4)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表:
实验一 | 实验二 | 实验三 | 实验四 | |
硝酸钾的质量/g | 20.0 | 25.0 | 30.0 | 35.0 |
所得溶液的质量/g | 120.0 | 125.0 | 130.0 | 131.6 |
根据上表数据,实验二所得的溶液为__________(填“饱和”或“不饱和”)溶液;20℃时,硝酸钾的溶解度为_________g。