题目内容
【题目】实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
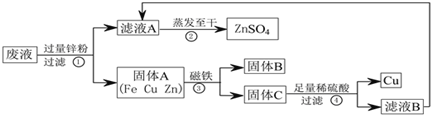
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是______________;固体B的化学式为________。
(2)写出步骤①其中一个反应的化学方程式_________________________;步骤④发生反应的化学方程式为________________________________。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是_____________。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和______________________________。
【答案】 硫酸锌 Fe Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe) Zn+H2SO4=ZnSO4+H2↑ 取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量 硫酸锌的质量、锌粉的质量
【解析】(1)由滤液A蒸发至干得到ZnSO4,由此可知滤液A和滤液B含有相同的溶质,其名称是硫酸锌;用磁铁吸出来的固体B是Fe;
(2)根据金属活动顺序,位于前面的金属能把位于后面的金属从它们的化合物溶液里置换出来,因此反应的化学方程式为: Zn+CuSO4=ZnSO4+Cu(或Zn+FeSO4=ZnSO4+Fe);
由实验过程可知步骤④发生反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)要检验步骤④中加入的稀硫酸是否足量的方法是:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量;
(4)根据溶质的质量分数=![]() ×100%可知要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和硫酸锌的质量、锌粉的质量。
×100%可知要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和硫酸锌的质量、锌粉的质量。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案