题目内容
(2009?天河区一模)请你结合下列装置图回答问题:
(1)写出有标号仪器的名称:a______,b______.
(2)实验室用甲装置制氧气的化学方程式是______ K2MnO4+MnO2+O2↑
【答案】分析:(1)熟悉常见的化学仪器,了解它们的名称;
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气;然后根据氧气不易溶于水,密度大于空气密度的特点选择收集方法;反应结束后,给冷却的试管加水过滤得到的黑色粉末是二氧化锰,它可以作为催化剂与过氧化氢溶液反应生成氧气;
(3)根据二氧化碳与澄清石灰水反应,使澄清石灰水[主要成分Ca(OH)2]变浑浊的性质判断试管内的现象,并据此写出反应式.
解答:解:(1)熟悉常见的化学仪器,了解它们的名称.图中a是酒精灯,b是锥形瓶.故答案为:酒精灯;锥形瓶;
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气.反应方程式是:2KMnO4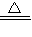 K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不溶于水,我们可用排水集气法(或向上排空气法)收集;加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2
K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不溶于水,我们可用排水集气法(或向上排空气法)收集;加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2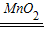 2H2O+O2↑.
2H2O+O2↑.
故答案分别为:2KMnO4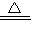 K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2
K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2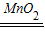 2H2O+O2↑、催化作用;
2H2O+O2↑、催化作用;
(3)乙装置中生成的二氧化碳气体,通过导管进入盛有澄清石灰水的试管,与澄清石灰水[主要成分Ca(OH)2]反应,生成白色沉淀碳酸钙.反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:白、Ca(OH)2+CO2=CaCO3↓+H2O.
点评:本题考查常见气体的制取与制取装置的选取,以及化学方程式的书写.考查知识点全面,而且是我们的常见问题.
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气;然后根据氧气不易溶于水,密度大于空气密度的特点选择收集方法;反应结束后,给冷却的试管加水过滤得到的黑色粉末是二氧化锰,它可以作为催化剂与过氧化氢溶液反应生成氧气;
(3)根据二氧化碳与澄清石灰水反应,使澄清石灰水[主要成分Ca(OH)2]变浑浊的性质判断试管内的现象,并据此写出反应式.
解答:解:(1)熟悉常见的化学仪器,了解它们的名称.图中a是酒精灯,b是锥形瓶.故答案为:酒精灯;锥形瓶;
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气.反应方程式是:2KMnO4
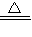 K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不溶于水,我们可用排水集气法(或向上排空气法)收集;加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2
K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不溶于水,我们可用排水集气法(或向上排空气法)收集;加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2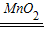 2H2O+O2↑.
2H2O+O2↑.故答案分别为:2KMnO4
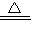 K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2
K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2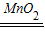 2H2O+O2↑、催化作用;
2H2O+O2↑、催化作用;(3)乙装置中生成的二氧化碳气体,通过导管进入盛有澄清石灰水的试管,与澄清石灰水[主要成分Ca(OH)2]反应,生成白色沉淀碳酸钙.反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:白、Ca(OH)2+CO2=CaCO3↓+H2O.
点评:本题考查常见气体的制取与制取装置的选取,以及化学方程式的书写.考查知识点全面,而且是我们的常见问题.

练习册系列答案
相关题目
(2009?天河区一模)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是______,碳酸钠的质量分数是______.(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质______(填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
表中数据a=______g,b=______g.并请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.

[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是______,碳酸钠的质量分数是______.(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质______(填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |

26.(2009?天河区一模)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是______,碳酸钠的质量分数是______.(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质______(填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
表中数据a=______g,b=______g.并请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.

[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是______,碳酸钠的质量分数是______.(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质______(填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |
