题目内容
【题目】长期饮用硬水易引起结石病,将硬水煮沸可以得到软水和水垢,水垢的主要成分是CaCO3和Mg(OH)2,若取100g水垢制取氯化钙的主要流程如下:
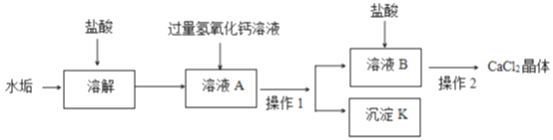
(1)往溶液A加入过量的氢氧化钙溶液,目的是________________。
(2)操作1的名称是____________,沉淀K是___________(用化学式表示)。
(3)在水垢中加入盐酸至水垢完全溶解,反应的化学方程式是______________。
(4)操作2中加热蒸发,要除去的物质有______________。在蒸发过程中,当__________时,停止加热,利用蒸发皿的余热使滤液蒸干。
(5)实验结束后若计算出水垢中碳酸钙的质量分数,需要称量沉淀K还是CaCl2晶体的质量?_______(填“沉淀K”或“CaCl2晶体”)
【答案】 完全除去氯化镁杂质 过滤 Mg(OH)2 CaCO3 + 2HCl = CaCl2 + H2O +CO2↑ 、Mg(OH)2 + 2HCl = MgCl2 + 2H2O H2O 、HCl 蒸发皿中出现较多量的固体 沉淀K
【解析】(1)在水垢中,加入盐酸溶解得到氯化钙和氯化镁,实验最终目的是得到氯化钙的晶体,所以往溶液A加入过量的氢氧化钙溶液,使氯化镁完全沉淀,这样后期就避免存在镁的化合物,而导致氯化钙不纯;
(2)操作1是得到沉淀和溶液,是固液分离的操作,在实验室中该操作为过滤;沉淀K是在氯化镁和氯化钙的混合溶液中加入了过量的氢氧化钙得到的,由于氢氧化钙和氯化钙不反应,而氯化镁和氢氧化钙反应生成了难溶性的氢氧化镁,所以该沉淀为氢氧化镁,故化学式为 Mg(OH)2;
(3)水垢的主要成分是CaCO3和Mg(OH)2,加入盐酸,盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3 + 2HCl = CaCl2 + H2O +CO2↑;氢氧化镁与盐酸反应生成氯化镁和水,化学方程式为:Mg(OH)2 + 2HCl = MgCl2 + 2H2O;
(4)操作2中加热蒸发,要得到氯化钙晶体,要除去过量的氯化氢和水,蒸发食盐水时,等到蒸发皿中出现较多量的固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
(5)由于CaCl2晶体的质量包含原水垢中的氯化钙和氯化镁和氢氧化钙反应生成的氯化钙以及盐酸与氢氧化钙反应生成的氯化钙,所以计算出水垢中碳酸钙的质量分数,只能根据沉淀K[Mg(OH)2]的质量进行计算。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案