题目内容
【题目】(7分)现欲探究一固体粉末状混合物A的成分,已知其中可能含有CuSO4、BaCO3、NH4NO3、Fe2O3、NaCl五种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
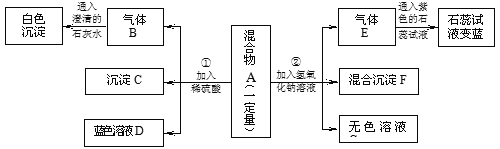
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)①沉淀C的化学式为 , ②气体E的化学式为
(2)在混合物A中,肯定不存在的物质是 (写化学式)
(3)在混合物A中,肯定存在的物质是 (写化学式)
(4)溶液D中一定存在的金属阳离子为 (写离子符号)
(5)写出实验过程②中肯定发生的一个反应化学方程式:
【答案】(1)①Ba2SO4 ②NH3
(2)Fe2O3
(3)CuSO4、BaCO3、NH4NO3
(4)Cu2+
(5)CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
【解析】
试题分析:加入硫酸还能得到沉淀说明沉淀是硫酸钡,说明原来一定有碳酸钡,根据提供的混合物中的物质看能产生气体说明气体只能是氨气,因为氨气显示碱性,说明原来有硝酸铵;过程中产生蓝色溶液说明原来有硫酸铜,如果含有氧化铁则会反应产生黄色的溶液,所以一定没有Fe2O3 。溶液D是硫酸铜,所以金属离子是铜离子,实验过程②中肯定发生的一个反应化学方程式CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目