题目内容
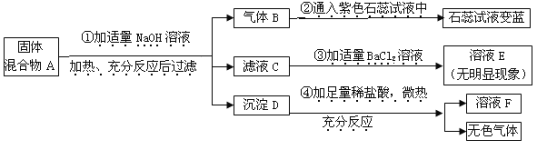
【题目】某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:
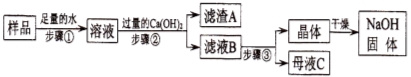
(1)步骤②反应的化学方程式为 ;加入过量Ca(OH)2的目的是________________
(2)滤液B中的溶质是 、 (写化学式);步骤③所包含的具体操作是加热浓缩、 、过滤。
(3)探究变质NaOH固体中碳酸钠的质量分数。
【设计实验】甲组同学:称取20.0g样品,放入足量的溶质质量分数为14.6%的稀盐酸直到反应停止,共收集到4.40g二氧化碳。
乙组同学:称取20.0g样品,加水配成溶液,向溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀10.0g。
【解决问题】
根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:___________。(请写出计算过程 Ca:40 C:12 O:16 H:1 Na:23)
【答案】(1)Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 将Na2CO3完全除尽
(2)NaOH、Ca(OH)2 结晶(3)53%
【解析】
试题分析:(1)步骤②是加入过量的Ca(OH)2溶液,根据碱的化学性质,碳酸钠能与Ca(OH)2发生反应,反应的化学方程式为:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是:将Na2CO3完全除尽
(2)反应后溶液中溶质成分的判断:看生成物还有看反应物是否过量,由于所加的Ca(OH)2溶液过量,故滤液B中的溶质是NaOH、Ca(OH)2,步骤③所包含的具体操作是加热浓缩、结晶、过滤
(3)根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2的质量关系,即可求出Na2CO3的质量,进而求出样品中碳酸钠的质量分数或根据化学方程式:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH中Na2CO3与CaCO3的质量关系,也可求出Na2CO3的质量
解:设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 4.4g
106:44=x:4.4g
x=10.6g
样品中碳酸钠的质量分数=10.6g/20g×100%=53%

【题目】小李在化学实验技能考查中,完成“用稀盐酸鉴别氢氧化钠溶液和碳酸钠溶液,并测碳酸钠溶液的pH”实验。
【实验一】小李取待测液甲、乙分别放置在试管①和②,再往两支试管中滴入稀盐酸,观察实验现象。根据现象推知,乙为碳酸钠溶液。
(1)实验中,小李应观察到试管②的现象是 ,该试管中反应的化学方程式为 。
(2)老师指出:除盐酸外,还可使用其它试剂鉴别氢氧化钠和碳酸钠溶液。请你选择一种不属于酸的试剂,并将鉴别实验中的预期现象以及化学方程式填入下表。
选择的试剂 | 预期现象 | 反应的化学方程式 |
一支试管无明显现象; 另一支试管 |
【实验二】小李用玻璃棒蘸取“实验一”后试管②中的溶液沾在pH试纸上,观察试纸颜色变化并与标准比色卡对照,读出溶液的pH。小李的记录如下:
实验现象 | 结论 |
溶液沾在试纸上,试纸缓慢地变色 | 与标准比色卡对比,Na2CO3溶液pH=3 |
(3)小李因操作错误,得出“Na2CO3溶液pH=3”的错误结论。指出小李操作错误之处。
答: 。
(4)指出小李记录的“实验现象”中不科学的地方 。