题目内容
 如图是A、B、C三种物质的溶解度曲线.试根据图象回答:
如图是A、B、C三种物质的溶解度曲线.试根据图象回答:
(1)当温度为______℃时,A、B、C三种物质的溶解度大小关系为SB=Sc>SA.
(2)t3℃时,在等质量的水中分别加入A、B两种物质配成饱和溶液,当温度降到t1℃后,析出晶体较多的是______.
(3)t3℃时,将30克A物质投入50克水中充分溶解后,得到的溶液是______溶液(填“饱和”或“不饱和”).该溶液的溶质质量分数为______.
(4)在t3℃时,分别用l00g水配制三杯A、B和C的饱和溶液(底部无固体残留).同时降温到t2℃,下列说法正确的是______
A.t2℃时,得到C的饱和溶液
B.t2℃时,得到A的不饱和溶液
C.温度降低到t2℃时,A、C的溶质质量分数相等,得到A、C的饱和溶液
D.温度降低到t2℃时,三杯溶液的溶质质量分数大小关系是:B>A>C.
解:(1)从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是SB=Sc>SA;
(2)曲线最陡的是A曲线,从t3℃降到t1℃后,A的溶解度减小的多,溶不了的多,所以析出的晶体多;
(3)t3℃时,A物质的溶解度是50g,即100g水中最多溶50g,所以50g水中最多溶25g,所以t3℃时,将30克A物质投入50克水中充分溶解后,只能溶解25g,得到的溶液是饱和溶液,溶质质量分数是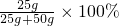 =33.3%;
=33.3%;
(4)A、曲线从t3℃降到t2℃后C的溶解度变大,所以变为不饱和溶液,故A错;
B、曲线从t3℃降到t2℃后A的溶解度减小,所以会析出晶体,仍然是饱和溶液,故B错;
C、曲线从t3℃降到t2℃后A的溶解度减小是饱和溶液,C的溶解度变大,所以变为不饱和溶液,溶质质量分数是不相等的,故C错;
D、曲线从t3℃降到t2℃后A和B的溶解度都减小,都变为饱和溶液,又因为饱和溶液的溶质质量分数与溶解度有关,溶解度大溶质质量分数就大,所以在t2℃B的溶解度大于A的,所以溶质质量分数也是B大于A;由于C降温后变为不饱和溶液,它的溶质质量分数不变,所以只要比较一下在t3℃C的溶解度与t2℃A和B的溶解度大小就行,因为t2℃A的溶解度大于t3℃C的溶解度,所以温度降低到t2℃时,三杯溶液的溶质质量分数大小关系是:B>A>C,故D正确.
故答案为:(1)t1;(2)A;(3)饱和;33.3%;(4)D.
分析:(1)根据某一温度时物质溶解度的比较方法考虑;(2)根据曲线的陡峭程度考虑;(3)根据t3℃时,A物质的溶解度考虑;(4)根据饱和溶液、不饱和溶液的判断,溶质质量分数的比较方法考虑本题.
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的影响因素,饱和溶液与不饱和溶液的判断.
(2)曲线最陡的是A曲线,从t3℃降到t1℃后,A的溶解度减小的多,溶不了的多,所以析出的晶体多;
(3)t3℃时,A物质的溶解度是50g,即100g水中最多溶50g,所以50g水中最多溶25g,所以t3℃时,将30克A物质投入50克水中充分溶解后,只能溶解25g,得到的溶液是饱和溶液,溶质质量分数是
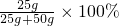 =33.3%;
=33.3%;(4)A、曲线从t3℃降到t2℃后C的溶解度变大,所以变为不饱和溶液,故A错;
B、曲线从t3℃降到t2℃后A的溶解度减小,所以会析出晶体,仍然是饱和溶液,故B错;
C、曲线从t3℃降到t2℃后A的溶解度减小是饱和溶液,C的溶解度变大,所以变为不饱和溶液,溶质质量分数是不相等的,故C错;
D、曲线从t3℃降到t2℃后A和B的溶解度都减小,都变为饱和溶液,又因为饱和溶液的溶质质量分数与溶解度有关,溶解度大溶质质量分数就大,所以在t2℃B的溶解度大于A的,所以溶质质量分数也是B大于A;由于C降温后变为不饱和溶液,它的溶质质量分数不变,所以只要比较一下在t3℃C的溶解度与t2℃A和B的溶解度大小就行,因为t2℃A的溶解度大于t3℃C的溶解度,所以温度降低到t2℃时,三杯溶液的溶质质量分数大小关系是:B>A>C,故D正确.
故答案为:(1)t1;(2)A;(3)饱和;33.3%;(4)D.
分析:(1)根据某一温度时物质溶解度的比较方法考虑;(2)根据曲线的陡峭程度考虑;(3)根据t3℃时,A物质的溶解度考虑;(4)根据饱和溶液、不饱和溶液的判断,溶质质量分数的比较方法考虑本题.
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的影响因素,饱和溶液与不饱和溶液的判断.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
 17、如图是A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题.
17、如图是A、B、C三种固体物质的溶解度曲线示意图,试回答下列问题. 29、如图是a、b、c三种固体物质的溶解度曲线图.
29、如图是a、b、c三种固体物质的溶解度曲线图. 16、如图是A、B、C三种固体物质的溶解度随温度变化的曲线图.根据图回答:
16、如图是A、B、C三种固体物质的溶解度随温度变化的曲线图.根据图回答: (1)如图是A、B、C三种物质的溶解度曲线.请回答:
(1)如图是A、B、C三种物质的溶解度曲线.请回答:
