题目内容
某工厂化验室用质量分数为20%的氢氧化钠溶液,洗涤一定量石油产品中的残余硫酸,共耗这种溶液30.0g,洗涤后溶液呈中性.这一定量的石油产品中,含多少克硫酸?
解:30.0g20%的氢氧化钠溶液中NaOH的质量=30.0g×20%=6.0g
设硫酸的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
6.0g x
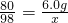
x=7.4g
答:这一定量的石油产品中含7.4g硫酸.
分析:氢氧化钠和硫酸发生中和反应,生成硫酸钠和水;反应至溶液呈中性,即恰好完全反应;根据反应的化学方程式,利用参加反应的氢氧化钠的质量计算反应所消耗硫酸的质量.
点评:利用化学方程式进行计算时,所使用的质量必须是纯净物的质量,不能使用溶液的质量进行计算.
设硫酸的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
6.0g x
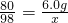
x=7.4g
答:这一定量的石油产品中含7.4g硫酸.
分析:氢氧化钠和硫酸发生中和反应,生成硫酸钠和水;反应至溶液呈中性,即恰好完全反应;根据反应的化学方程式,利用参加反应的氢氧化钠的质量计算反应所消耗硫酸的质量.
点评:利用化学方程式进行计算时,所使用的质量必须是纯净物的质量,不能使用溶液的质量进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2005?太原)某工厂化验室用10%的NaOH溶液洗涤石油产品中的残余硫酸.
(2005?太原)某工厂化验室用10%的NaOH溶液洗涤石油产品中的残余硫酸.