题目内容
我国目前使用的燃料主要是煤和石油,含硫的煤燃烧时生成的SO2会污染空气.某中学化学兴趣小组同学取某火力发电厂废气2m3 通入4g 0.0254%的碘(I2)溶液中恰好完全反应,反应的化学方程式是:SO2+I2+2H2O=H2SO4+2HI.计算该厂排放的废气中SO2含量是否符合国家标准(国家标准规定工业废气中SO2含量不得超过0.15mg/m3).
分析:依据化学方程式中碘溶液中碘的质量可以求出二氧化硫的质量,从而可判断废气中二氧化硫的含量是否符合国家标准.
解答:解:设2m3工业废气中含有SO2的质量为x
SO2+2H2O+I2=H2SO4+2HI
64 254
x 0.0254%×4g
=
解之得,x=2.56×10-4g
=1.28×10-4g/m3=0.128mg/m3<0.15mg/m3
符合国家标准.
答:该厂排放的废气中SO2含量符合国家标准.
SO2+2H2O+I2=H2SO4+2HI
64 254
x 0.0254%×4g
| 64 |
| 254 |
| x |
| 0.0254%×4g |
解之得,x=2.56×10-4g
| 2.56×10-4g |
| 2m3 |
符合国家标准.
答:该厂排放的废气中SO2含量符合国家标准.
点评:本题为根据化学方程式的基本计算,在最后与级别标准对比时要注意:根据化学方程式计算所得值为2m3空气中二氧化硫的质量,因此比较时还需要将数值转换成标准值进行判断.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
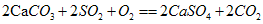 ,实验证明石灰浆[Ca(OH)2]在空气中也可吸收SO2生成硫酸钙和其他物质,写出该反应的化学方程式:________________________________。
,实验证明石灰浆[Ca(OH)2]在空气中也可吸收SO2生成硫酸钙和其他物质,写出该反应的化学方程式:________________________________。