题目内容
酸雨是pH小于5.6的降水.我国大部分地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的二氧化硫气体,经过一系列化学反应而形成的.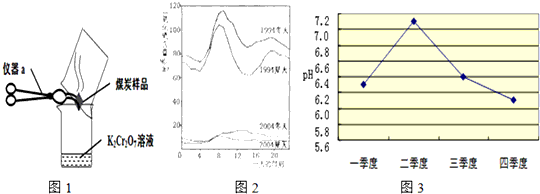
(1)如果硫粉在氧气中燃烧,观察到的现象是________,该反应的化学方程式为________.
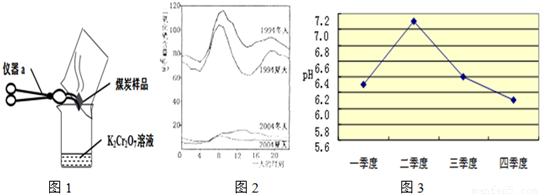
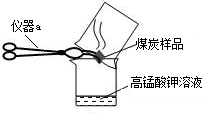
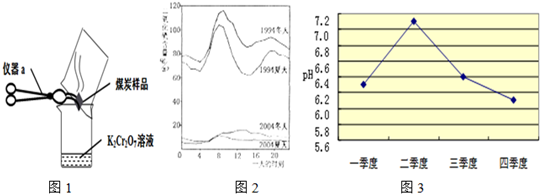
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:________.他们查阅资料后得知:“二氧化硫能使K2Cr2O7溶液褪色(由橙红色变成绿色),反应方程式为:“3SO2+K2Cr2O7+H2SO4═K2SO4+ +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:________.反应前K2Cr2O7中Cr元素化合价为________价.
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:________.反应前K2Cr2O7中Cr元素化合价为________价.
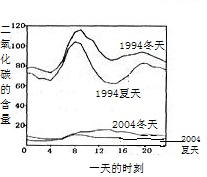
(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是________
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作________.
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:________.酸雨会使河流、湖泊酸化.如图3是某市去年某河流一年中不同时期河水的平均pH变化的折线图.则去年河水酸性最强的季度是第________季度.该季度雨水酸性最强的原因可能是:(答两条)________;________.
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式________.
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量________g.
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
解:(1)硫在氧气中剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体.化学方程式为S+O2 SO2.故答案为:剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体;S+O2
SO2.故答案为:剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体;S+O2 SO2;
SO2;
(2)所示仪器为常用的仪器坩埚钳;根据质量守恒定律可推出化学式为Cr2(SO4)3,由于硫酸根的化合价为-2价,整个化学式各元素化合价的代数和为零,K2Cr2O7中Cr元素化合价为+6价.故答案为:坩埚钳;Cr2(SO4)3;+6;
(3)汽车尾气中含有一氧化碳、氧化氮以及对人体产生不良影响的其他一些固体颗粒,再说即使汽车产生污染,也不能禁止使用;故答案为:D
(4)本题考查了如何测溶液的pH,方法是:用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值;由表中数据知,PH值是越来越小,即酸性越来越强,雨水中的H2SO3被氧气氧化为H2SO4,化学方程式为2H2SO3+O2=2H2SO4.故答案为:用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值;强;2H2SO3+O2=2H2SO4;
(5)为了减缓石刻腐蚀,就是减少酸雨的形成,也就是尽量减少酸性气体的排放,如采用脱硫技术,使用清洁能源,加强对空气的质量监控等;从图象知河水酸性最强的季度是第四季度;该季度雨水酸性最强的原因可能是冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染;或因为冬季降水量减少,河水中酸的浓度增大等.
硫酸和熟石灰反应生成硫酸钙和水方程式为H2SO4+Ca(OH)2=CaSO4+2H2O.故答案为:使用清洁能源;四;冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染.冬季降水量减少,河水中酸的浓度增大.H2SO4+Ca(OH)2=CaSO4+2H2O.
(6)①由题意知,溶液质量增重了0.64g,也就是二氧化硫的质量为0.64g;故答案为0.64g
②解:设产生0.64g SO2,需要NaOH的质量为X
2NaOH+SO2═Na2SO3+H2O
80 64
X 0.64g
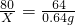
X=0.8g
答:发生反应的NaOH的质量为0.8g
③空气的质量为:1000L×1.3g/L=1300g
则空气中SO2的质量分数为:
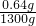 ×100%=0.05%
×100%=0.05%
答:空气中SO2的质量分数0.05%
分析:(1)根据硫在氧气中燃烧的现象进行解答;
(2)仪器a的名称坩埚钳;根据化学反应前后原子的种类和数目不变以及化合物中各元素的化合价的代数和为0进行解答;
(3)根据图示进行解答;
(4)根据测定pH的方法进行解答;
(5)考查酸雨的形成及危害;
(6)利用方程式计算,注意解题步骤.
点评:本题通过一系列的题目的解答,让我们知道酸雨的形成、危害及其有效治理,同时给我们敲响了警钟:保护空气,就是保护我们的生命.
 SO2.故答案为:剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体;S+O2
SO2.故答案为:剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体;S+O2 SO2;
SO2;(2)所示仪器为常用的仪器坩埚钳;根据质量守恒定律可推出化学式为Cr2(SO4)3,由于硫酸根的化合价为-2价,整个化学式各元素化合价的代数和为零,K2Cr2O7中Cr元素化合价为+6价.故答案为:坩埚钳;Cr2(SO4)3;+6;
(3)汽车尾气中含有一氧化碳、氧化氮以及对人体产生不良影响的其他一些固体颗粒,再说即使汽车产生污染,也不能禁止使用;故答案为:D
(4)本题考查了如何测溶液的pH,方法是:用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值;由表中数据知,PH值是越来越小,即酸性越来越强,雨水中的H2SO3被氧气氧化为H2SO4,化学方程式为2H2SO3+O2=2H2SO4.故答案为:用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值;强;2H2SO3+O2=2H2SO4;
(5)为了减缓石刻腐蚀,就是减少酸雨的形成,也就是尽量减少酸性气体的排放,如采用脱硫技术,使用清洁能源,加强对空气的质量监控等;从图象知河水酸性最强的季度是第四季度;该季度雨水酸性最强的原因可能是冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染;或因为冬季降水量减少,河水中酸的浓度增大等.
硫酸和熟石灰反应生成硫酸钙和水方程式为H2SO4+Ca(OH)2=CaSO4+2H2O.故答案为:使用清洁能源;四;冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染.冬季降水量减少,河水中酸的浓度增大.H2SO4+Ca(OH)2=CaSO4+2H2O.
(6)①由题意知,溶液质量增重了0.64g,也就是二氧化硫的质量为0.64g;故答案为0.64g
②解:设产生0.64g SO2,需要NaOH的质量为X
2NaOH+SO2═Na2SO3+H2O
80 64
X 0.64g
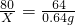
X=0.8g
答:发生反应的NaOH的质量为0.8g
③空气的质量为:1000L×1.3g/L=1300g
则空气中SO2的质量分数为:
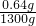 ×100%=0.05%
×100%=0.05% 答:空气中SO2的质量分数0.05%
分析:(1)根据硫在氧气中燃烧的现象进行解答;
(2)仪器a的名称坩埚钳;根据化学反应前后原子的种类和数目不变以及化合物中各元素的化合价的代数和为0进行解答;
(3)根据图示进行解答;
(4)根据测定pH的方法进行解答;
(5)考查酸雨的形成及危害;
(6)利用方程式计算,注意解题步骤.
点评:本题通过一系列的题目的解答,让我们知道酸雨的形成、危害及其有效治理,同时给我们敲响了警钟:保护空气,就是保护我们的生命.

练习册系列答案
相关题目
 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式: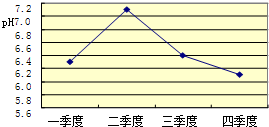
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式: