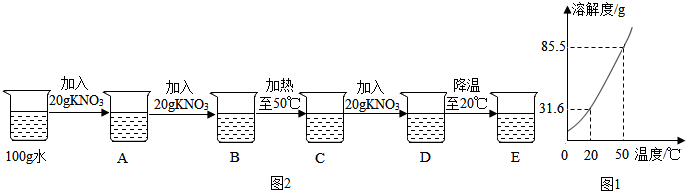
题目内容
现有氯酸钾和二氧化锰组成的混合物32g,加热到不再分解为止,称得剩余固体的质量为22.4g,求:
(1)生成氧气多少克?
(2)剩余固体中氯化钾和二氧化锰各多少克?
(1)生成氧气多少克?
(2)剩余固体中氯化钾和二氧化锰各多少克?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据质量守恒定律,由反应前后固体物质的质量差,可求得放出气体氧气的质量;
(2)根据反应的化学方程式,利用生成氧气的质量可计算混合物中氯酸钾的质量和生成的氯化钾的质量,并可求得二氧化锰的质量.
(2)根据反应的化学方程式,利用生成氧气的质量可计算混合物中氯酸钾的质量和生成的氯化钾的质量,并可求得二氧化锰的质量.
解答:解:(1)根据质量守恒定律,待反应至不再有气体生成后,制取氧气的质量为:32g-22.4g=9.6g;
(2)设原混合物中氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3
2KCl+3O2↑
245 149 96
x y 9.6g
=
=
解得:x=24.5g,y=14.9g
二氧化锰的质量为:32g-24.5g=7.5g
答:(1)制取氧气的质量为9.6g;
(2)剩余固体中氯化钾的质量为14.9g,二氧化锰的质量为7.5g.
(2)设原混合物中氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3
| ||
| △ |
245 149 96
x y 9.6g
| 245 |
| x |
| 149 |
| y |
| 96 |
| 9.6g |
解得:x=24.5g,y=14.9g
二氧化锰的质量为:32g-24.5g=7.5g
答:(1)制取氧气的质量为9.6g;
(2)剩余固体中氯化钾的质量为14.9g,二氧化锰的质量为7.5g.
点评:解答此类题的方法是:首先利用质量守恒定律,根据反应前后固体物质质量差求得反应生成气体的质量;然后,利用化学方程式由气体质量计算其他物质的质量.

练习册系列答案
相关题目
空气成分按体积计算,含量约占21%的是( )
| A、氮气 | B、二氧化碳 |
| C、氧气 | D、稀有气体 |
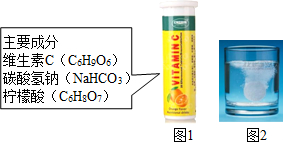 某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学进行如下探究.
某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学进行如下探究.