题目内容
5.6g含杂质的铁片加到足量的稀硫酸中,共收集到0.18g氢气,该铁片中不可能含有的杂质是
- A.铜
- B.镁
- C.锌
- D.银
B
分析:A、B、C、D四个选项中依据金属活动性顺序,可判断A、D不与酸反应放出氢气,同质量铁、镁与锌与酸反应时,镁比铁生成的氢气多,锌比铁生成的氢气少,假设5.6g全是铁时看生成的氢气量是多少,再结合前面的判断就可达到目的.
解答:假设5.6g全是铁时生成的氢气量是x
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g x
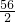 =
=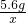
x=0.2g
比实际生成的氢气多,故掺入的金属同质量时生成的氢气要比铁少,故A、C、D都行
故选B.
点评:此题是利用假设的方法分析问题,采用的是平均值判断,结合了化学方程式的有关计算,训练了学生的思维.
分析:A、B、C、D四个选项中依据金属活动性顺序,可判断A、D不与酸反应放出氢气,同质量铁、镁与锌与酸反应时,镁比铁生成的氢气多,锌比铁生成的氢气少,假设5.6g全是铁时看生成的氢气量是多少,再结合前面的判断就可达到目的.
解答:假设5.6g全是铁时生成的氢气量是x
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g x
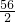 =
=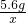
x=0.2g
比实际生成的氢气多,故掺入的金属同质量时生成的氢气要比铁少,故A、C、D都行
故选B.
点评:此题是利用假设的方法分析问题,采用的是平均值判断,结合了化学方程式的有关计算,训练了学生的思维.

练习册系列答案
相关题目
5.6g含杂质的铁片加到足量的稀硫酸中,共收集到0.18g氢气,该铁片中不可能含有的杂质是( )
| A、铜 | B、镁 | C、锌 | D、银 |
5.6g含杂质的铁片加到足量的稀硫酸中,共收集到0.21g氢气,该铁片中不可能含有的杂质是( )
| A、铜 | B、锌 | C、镁 | D、铝 |