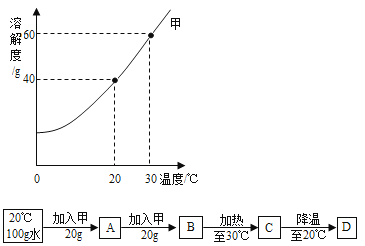
题目内容
【题目】20g质量分数为49%的硫酸与6g铁钉恰好完全反应(铁钉中的杂质不参加反应).(反应的化学方程式:H2SO4+Fe═FeSO4+H2↑)
(1)计算该铁钉中铁的质量分数.
(2)将20g质量分数为49%的硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【答案】
(1)
解:参加反应的硫酸溶质的质量是20g×49%=9.8g
设参加反应的铁的质量是x
H2SO4 + Fe ═ FeSO4 + H2↑
98 56
9.8g x
![]()
解得:x=5.6g
所以铁钉中铁的质量分数是 =93.3%
(2)
由于在稀释前后溶质的质量保持不变,所以设需要水的质量是y
20g×49%=(20g+y)×20% 解得:y=29g
【解析】解答:本题是关于溶质的质量分数和化学方程式的综合计算,注意20g的稀硫酸是混合物,不能直接带入计算,必须先要算出溶质硫酸的质量才能进行计算。
①参加反应的硫酸溶质的质量是20g×49%=9.8g,设参加反应的铁的质量是x
H2SO4 + Fe ═ FeSO4 + H2↑
98 56
9.8g x![]() 解得:x=5.6g
解得:x=5.6g
所以铁钉中铁的质量分数是 ![]() =93.3%
=93.3%
②由于在稀释前后溶质的质量保持不变,所以设需要水的质量是y
20g×49%=(20g+y)×20% 解得:y=29g
所以(1)该铁钉中铁的质量分数93.3%;(2)需要水的质量是29g.
分析:根据反应的硫酸的质量并结合化学方程式,列方程求出铁的质量,并计算铁钉中铁的质量分数;溶液稀释前后溶质的质量不变.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目