��Ŀ����
����Ŀ����ͼΪ��һ����̼����������Ӧ����ʵ��װ�á�
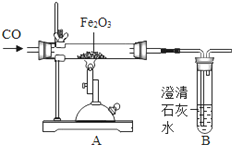
��1����ɸ�ʵ�飬�ܿ���A�е�������__________________________________��
��2��ʵ������У���װ��ĩ�˵ĵ��ܿڷ�һȼ�ŵľƾ��ƣ����洦�ڵ��ܿڣ�����������Ŀ����______________________________________��
��3��ͨ��Bװ�ÿɼ���A�е������ﺬ��CO2���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
��4������ͨCO2�����ٽ��д�ʵ�飬ͨ���ԱȻ�ó�CO��CO2��ѧ���ʵIJ�ͬ�㡣
����д�����е�һ��______________________________________��
���Դ��۵ĽǶȷ���CO��CO2��ѧ���ʲ�ͬ��ԭ����________________________��
��5��ij������ÿ��������4900t��Fe2O3 76%�ij�����ʯ������������ó������Ͽ��ղ���Fe98%������������_________(���ݻ�ѧ����ʽ��ʽ����) ��
���𰸡� ��ɫ��ĩ���ɫ ��ȼβ���е�CO����ֹ��Ⱦ���� CO2 + Ca(OH)2��CaCO3�� + H2O CO���п�ȼ�ԣ�CO2û�� ���ӵĹ��ɲ�ͬ 2660t
�����������⿼����һ����̼��ԭ�������ķ�Ӧԭ����ʵ�鲽����ע�������Լ������ʵļ������
��1��һ����̼���������ڸ��µ��������������Ͷ�����̼��������ɸ�ʵ�飬�ܿ���A�е������ǣ���ɫ��ĩ���ɫ��
��2��һ����̼�ж���Ҫβ��������������װ��ĩ�˵ĵ��ܿڷ�ȼ�ŵľƾ��ƣ�������ڵ��ܿڣ���Ŀ���ǣ���ȼβ���е�CO����ֹ��Ⱦ������
��3���������ƺͶ�����̼��Ӧ����̼��Ƴ�����ˮ����ѧ����ʽΪ��CO2 + Ca(OH)2��CaCO3�� + H2O��
��4��CO��CO2��ѧ���ʵIJ�ͬ���ǣ�CO���п�ȼ�ԣ�CO2û�У����۵ĽǶȷ���CO��CO2��ѧ���ʲ�ͬ��ԭ���ǣ����ӹ��ɲ�ͬ��
��5���������Ͽ��ղ���Fe 98%������������Ϊx
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
4900t��76% x��98%
![]() =
=![]()
x=2660t

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���±��е����ʡ���Ҫ�ɷֵĻ�ѧʽ����;���߶�Ӧ��ϵ��ȷ���ǣ�������
ѡ�� | ���� | ��Ҫ��ѧ�ɷ� | ��; |
A | ʯ��ˮ | CaO | �ɸ����������� |
B | ��Ȼ�� | CO | ����ȼ�� |
C | ����ʯ | CaCO3 | ������������ |
D | 98%��Ũ���� | H2O | ����ijЩ�������� |
A.AB.BC.CD.D