题目内容
【题目】图中A、B、C分别表示三种不同的固体物质(不含结晶水),其溶解度曲线如图所示。请回答下列问题:
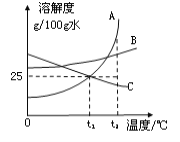
① t1℃时,100g水中最多溶解固体A______g。
② t2℃时,三种固体物质溶解度由小到大的顺序是__________。
③ t1℃时,将30g固体C加到50g水中,充分搅拌后所得溶液的质量为_________g。
④ 写出一种将固体B的不饱和溶液转化为饱和溶液的方法_______________。
⑤ 若用溶质质量分数为16%的A溶液和蒸馏水来配制l00g溶质质量分数为10%的A溶液。则所需16%的A溶液与蒸馏水的质量比为_____________。
⑥ 一定温度下,向图4烧杯中加入一定量的水,如图5所示,所得溶液与原溶液相比,判断一定正确的是_______(选填编号)。

A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
【答案】25C B A62.5g加溶质或恒温蒸发溶剂5:3C
【解析】溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% 。由图可知① t1℃时,100g水中最多溶解固体25g。② t2℃时,三种固体物质溶解度由小到大的顺序是C> B> A。③ t1℃时,将30g固体C加到50g水中,充分搅拌后溶解12.5g,溶质为12.5g,溶液的质量等于溶质和溶剂的质量和, 所得溶液的质量为63.5g。
④写出一种将固体B的不饱和溶液转化为饱和溶液的方法饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。所要使固体物质的不饱和溶液变为饱和溶液的方法是增加溶质或恒温蒸发溶剂。加水稀释时溶液质量增加,溶质的质量不变,溶液中溶质的质量分数=![]() ×100%,若用溶质质量分数为16%的A溶液和蒸馏水来配制l00g溶质质量分数为10%的A溶液。设需要水的质量为x,(100g-x)×16%=l00g×10%, 溶质质量分数为16%的A溶液的质量为100-x,计算得溶液和水的质量比为5:3; 定温度下,向图4烧杯中加入一定量的水,原剩余固体会继续溶解,如果得到的是饱和溶液,则溶质的质量分数与原溶液相同;如得到的是不饱和溶液,则溶质的质量分数小于原溶液的质量分数,但溶解固体的质量比原溶液增多,所以溶质的质量一定比原溶液多。溶解度受温度影响,温度不变,物质的溶解度不变。
×100%,若用溶质质量分数为16%的A溶液和蒸馏水来配制l00g溶质质量分数为10%的A溶液。设需要水的质量为x,(100g-x)×16%=l00g×10%, 溶质质量分数为16%的A溶液的质量为100-x,计算得溶液和水的质量比为5:3; 定温度下,向图4烧杯中加入一定量的水,原剩余固体会继续溶解,如果得到的是饱和溶液,则溶质的质量分数与原溶液相同;如得到的是不饱和溶液,则溶质的质量分数小于原溶液的质量分数,但溶解固体的质量比原溶液增多,所以溶质的质量一定比原溶液多。溶解度受温度影响,温度不变,物质的溶解度不变。

【题目】(1)A~F是初中化学中的常见物质,如图所示是它们之间的转化关系,图中部分反应物或生成物未全部标出。已知:A是天然气的主要成分,B在常温下为液态,F是黑色粉末。

① A物质的化学式为______________;
② B→D是__________反应(填“放热”或“吸热”);
③ 在C→E的反应中,C物质发生______________(填“氧化反应”或“还原反应”);
④ 写出E→F反应的化学方程式:_________________________。
(2)设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是______。
编号 | A | B |
实验设计 |
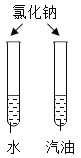
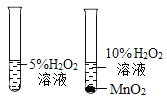
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究MnO2对过氧化氢分解的影响 |