题目内容
【题目】根据下列图像回答:

(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线。向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为________(填离子符号)。
(2)图二是20 ℃时,取10 mL 10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系
①由图可知中和反应是放热反应,你的依据为____________。
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为_____。
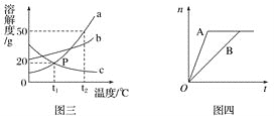
(3)图三是a、d、c三种物质的溶解度曲线。a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用________的方法达到饱和状态。
②将t2℃时,150 g a物质的饱和溶液降温到t1℃时。可以析出________g a物质。
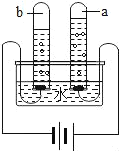
(4)下图托盘天平两边是等质量的铁和镁分别跟等质量等浓度的稀硫酸反应,反应时间t与生成氢气质量n的变化关系如图四。
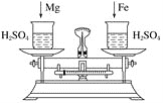
试回答:从开始反应到不再产生气体为止,天平指针偏转情况是_________。
【答案】H+、Na+、Cl- 反应过程中温度不断升高,完全反应时放出的热量最多 氢氧化钠固体溶于水时也要放出热量 升高温度 30 先偏向右边,最后回到分度盘中央
【解析】
(1)根据图示可知,m点对应的溶液的pH值小于7,即此时溶液为酸性。说明该点对应的溶液中酸还未反应完。所以溶液中的溶质有:盐酸 (未反应完的)和氯化钠(反应生成的)。 所含的离子为H+、Cl-、Na+。
(2)①根据图示可知,随着盐酸的加入溶液的温度逐渐升高。当加入的盐酸与氢氧化钠恰好完全反应时,溶液的温度达到最大值。可说明盐酸与氢氧化钠反应能够放出热量。②如改用氢氧化钠固体,则不能说明反应为放热反应。因为氢氧化钠在溶解于水时也能放出热量。无法确认温度的升高来源于氢氧化钠与盐酸的反应。
(3)①t1℃时,c物质的溶液接近饱和,即可继续溶解c物质,所以可通过再加入c物质的方法使其饱和。因为c物质的溶解度随着温度的升高而降低,所以还可以通过升温的方法,使c物质在相同的溶剂中溶解的质量变小,从而使其溶液由接近饱和变为饱和。
②根据图示可知,在t2℃时a物质的溶解度为50 g。即在t2℃时,a物质在100 g水里溶解达到饱和状态时所溶解的质量为50 g。所以在t2℃时150 g a物质的饱和溶液中含a 50 g,溶剂水的质量为100 g。当溶液的温度降低至t1℃时,其溶解度为20 g。即在t2℃时,a物质在100 g水里最多溶解20 g。所以此时析出固体的质量为50 g-20 g= 30 g。
(4)开始时天平左右两盘分别放有等质量的金属和酸,所以开始时天平平衡。随着反应的进行,镁反应较快,所以天平放镁的一方偏轻;天平偏向放铁的右盘。当反应停止时,二者反应生成氢气的质量相等,即两盘中质量的减少值是相等的。所以最终天平左右两盘剩余物质的质量相等,即天平最平衡。

 名校课堂系列答案
名校课堂系列答案【题目】KCl 和 KNO3 的溶解度表及溶解度曲线如图所示,下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度 S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
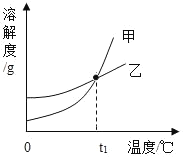
A. 甲表示 KNO3 溶解度曲线
B. 温度 t1 应在 20℃~30℃之间
C. 40℃时,5gKCl 加入 10g 水中,可得到 33.3%的溶液
D. 50℃时,30g KNO3 加入 50g 水,充分溶解,再降温到 30℃,有晶体析出