题目内容
10克碳酸钙跟30克稀盐酸恰好完全反应,求:
(1)可制得二氧化碳多少升?(CO2的密度为g/L)________
(2)这种盐酸的溶质质量分数是多少?________
(3)上述反应后所得溶液的溶质质量分数是多少?________.
解:设生成二氧化碳质量为x,生成氯化钙质量为y,30克稀盐酸中氯化氢的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
10g z y x
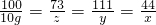
解之得:x=4.4g、y=11.1g、z═7.3g
(1)可制得二氧化碳的体积为: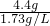 ═2.54L 故答案为:2.54L
═2.54L 故答案为:2.54L
(2)盐酸的溶质质量分数为: ═24.3% 故答案为:24.3%
═24.3% 故答案为:24.3%
(3)反应后溶液中溶质的质量分数= ≈31.2% 故答案为:31.2%
≈31.2% 故答案为:31.2%
分析:(1)根据反应的化学方程式和碳酸钙的质量可求得二氧化碳的质量,根据密度可求得二氧化碳的体积;
(2)根据反应的化学方程式和碳酸钙的质量可求得恰好完全反应时30克稀盐酸中氯化氢的质量;
(3)反应后所得溶液为氯化钙溶液,根据反应的化学方程式和碳酸钙的质量可求得氯化钙的质量
点评:本题主要考查学生运用化学方程式、质量守恒定律和质量分数公式进行计算的能力.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
10g z y x
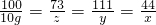
解之得:x=4.4g、y=11.1g、z═7.3g
(1)可制得二氧化碳的体积为:
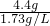 ═2.54L 故答案为:2.54L
═2.54L 故答案为:2.54L (2)盐酸的溶质质量分数为:
 ═24.3% 故答案为:24.3%
═24.3% 故答案为:24.3%(3)反应后溶液中溶质的质量分数=
 ≈31.2% 故答案为:31.2%
≈31.2% 故答案为:31.2%分析:(1)根据反应的化学方程式和碳酸钙的质量可求得二氧化碳的质量,根据密度可求得二氧化碳的体积;
(2)根据反应的化学方程式和碳酸钙的质量可求得恰好完全反应时30克稀盐酸中氯化氢的质量;
(3)反应后所得溶液为氯化钙溶液,根据反应的化学方程式和碳酸钙的质量可求得氯化钙的质量
点评:本题主要考查学生运用化学方程式、质量守恒定律和质量分数公式进行计算的能力.

练习册系列答案
相关题目