题目内容
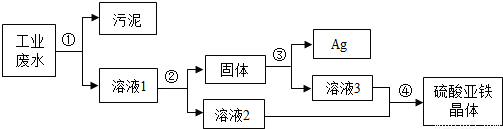
(2008?宿迁)有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥.某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体.方案流程如下:

回答下列问题:
(1)步骤②中:需加入的物质是
(2)步骤③中:需加入的物质是
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?
(4)步骤④的操作是

回答下列问题:
(1)步骤②中:需加入的物质是
Fe
Fe
,分离所得混合物的方法是过滤
过滤
.(2)步骤③中:需加入的物质是
稀硫酸
稀硫酸
,发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?
不合理
不合理
,理由是使Ag+完全置换出来,必须加入过量的铁
使Ag+完全置换出来,必须加入过量的铁
.(4)步骤④的操作是
蒸发结晶
蒸发结晶
,溶液2和溶液3为什么要混合?两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用
两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用
.分析:(1)此过程是对银的分离,为了不引入新的杂质此处应放金属铁,由于是溶液与银的分离故可采用过滤的方法完成.
(2)由于固体中含有银与过量的铁,所以要得到纯净的银应该消耗掉金属铁,加稀硫酸可使铁被消耗.
(3)不加稀硫酸时铁粉无法除掉,此处过量的铁粉是必须要加的,因为只有②中加入过量的铁粉才能使银能被彻底置换出来.
(4)从溶液中得到硫酸亚铁可采用蒸发溶剂的方法进行,溶液2、3中都含有硫酸亚铁为综合利用应该使其混合.
(2)由于固体中含有银与过量的铁,所以要得到纯净的银应该消耗掉金属铁,加稀硫酸可使铁被消耗.
(3)不加稀硫酸时铁粉无法除掉,此处过量的铁粉是必须要加的,因为只有②中加入过量的铁粉才能使银能被彻底置换出来.
(4)从溶液中得到硫酸亚铁可采用蒸发溶剂的方法进行,溶液2、3中都含有硫酸亚铁为综合利用应该使其混合.
解答:解:(1)此过程是置换出银的过程,为了在不引入新的杂质的前提下用金属铁置换较为合适,由于分离的方法是溶液与银的分离故可采用过滤的方法完成.
故答案为:Fe;过滤.
(2)为把银能彻底置换出来加入铁的质量应该是过量的,因此固体中含有银与过量的铁,所以要得到纯净的银应该消耗掉金属铁,加稀硫酸可使铁被消耗又不引入新的杂质.
故答案为:稀硫酸;Fe+H2SO4=FeSO4+H2↑.
(3)由于固体中既有银又有铁,不加稀硫酸时铁粉无法除掉,此处过量的铁粉是一定存在的的,因为只有②中加入过量的铁粉才能使银能被彻底置换出来.
故答案为:不合理;因为要使Ag+完全置换出来,必须加入过量的铁.
(4)从溶液中得到硫酸亚铁溶质可采用蒸发溶剂的方法进行,因为溶液2、3中都含有硫酸亚铁为综合利用减小浪费应该使其混合.
故答案为:蒸发结晶;两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用
故答案为:Fe;过滤.
(2)为把银能彻底置换出来加入铁的质量应该是过量的,因此固体中含有银与过量的铁,所以要得到纯净的银应该消耗掉金属铁,加稀硫酸可使铁被消耗又不引入新的杂质.
故答案为:稀硫酸;Fe+H2SO4=FeSO4+H2↑.
(3)由于固体中既有银又有铁,不加稀硫酸时铁粉无法除掉,此处过量的铁粉是一定存在的的,因为只有②中加入过量的铁粉才能使银能被彻底置换出来.
故答案为:不合理;因为要使Ag+完全置换出来,必须加入过量的铁.
(4)从溶液中得到硫酸亚铁溶质可采用蒸发溶剂的方法进行,因为溶液2、3中都含有硫酸亚铁为综合利用减小浪费应该使其混合.
故答案为:蒸发结晶;两种滤液中都含有硫酸亚铁,可得到更多的硫酸亚铁,综合利用
点评:此题是一道金属回收题,解题的关键是要明确回收的原理,结合题目内的框题进行分析探讨,是一道分离混合物的综合题.

练习册系列答案
相关题目