题目内容
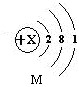
M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图1:

(1)该原子有
(2)M元素的化学性质与图2中
(3)M元素的离子符号是
(4)M元素和第(2)小题的D元素形成化合物的化学式是

(1)该原子有
3
3
个电子层,X的值是11
11
,M元素属于金属
金属
(填“金属”或“非金属”)元素,位于元素周期表的第3
3
周期.(2)M元素的化学性质与图2中
A
A
(填序号)元素的化学性质相似.结合如图元素周期表的信息,用化学用语回答:(3)M元素的离子符号是
Na+
Na+
;(4)M元素和第(2)小题的D元素形成化合物的化学式是
NaCl
NaCl
.分析:(1)根据原子的核内质子数=核外电子数,再由原子结构示意图可知,X的值为11;根据金属元素的原子,最外层电子数一般小于4个,所以该元素为金属元素;
(2)元素的化学性质与最外层电子数有关,所以最外层电子数相同的元素化学性质相似;M元素与A元素最外层电子数相同,所以M元素的化学性质与A的化学性质相似;
(3)M元素的原子最外层电子数为1,为金属元素,易失去电子,从而成为阳离子;
(4)由题中信息可知,第(2)小题的D元素的原子易得1个电子,M元素的原子易失1个电子;则可求M元素和D元素形成化合物.
(2)元素的化学性质与最外层电子数有关,所以最外层电子数相同的元素化学性质相似;M元素与A元素最外层电子数相同,所以M元素的化学性质与A的化学性质相似;
(3)M元素的原子最外层电子数为1,为金属元素,易失去电子,从而成为阳离子;
(4)由题中信息可知,第(2)小题的D元素的原子易得1个电子,M元素的原子易失1个电子;则可求M元素和D元素形成化合物.
解答:解:(1)根据原子的核内质子数=核外电子数和金属元素的原子,最外层电子数一般小于4个,再由原子结构示意图可知,该原子有3个电子层,X的值为11,该元素为金属元素,由于有三个电子层所以M为第三周期的元素;
(2)元素的化学性质与最外层电子数有关,所以最外层电子数相同的元素化学性质相似;由题目中的信息可知,故M元素的化学性质与A的化学性质相似;
(3)M元素的原子最外层电子数为1,易失去电子,成为阳离子,故M元素的离子符号是Na+;
(4)第(2)小题的D元素的原子易得2个电子,M元素的原子易失1个电子;则M元素和D元素形成化合物的化学式为Na2S
故答为:(1)3;11;金属;3;(2)A;(3)Na+;(4)NaCl;
(2)元素的化学性质与最外层电子数有关,所以最外层电子数相同的元素化学性质相似;由题目中的信息可知,故M元素的化学性质与A的化学性质相似;
(3)M元素的原子最外层电子数为1,易失去电子,成为阳离子,故M元素的离子符号是Na+;
(4)第(2)小题的D元素的原子易得2个电子,M元素的原子易失1个电子;则M元素和D元素形成化合物的化学式为Na2S
故答为:(1)3;11;金属;3;(2)A;(3)Na+;(4)NaCl;
点评:本题主要考查原子结构示意图的意义,由题目给出信息,推断该元素的原子构成,对于原子构成的一些规律应当熟记.了解核外电子在化学变化中的作用和元素的简单分类,掌握化学符合及其周围的数字的意义;以上这些往往是解题的关键所在.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目



 15、M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如右:
15、M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如右:
 M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图:
M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图:
 M元素的单质可用于原子反应堆的导热剂,其原子结构示意图:
M元素的单质可用于原子反应堆的导热剂,其原子结构示意图: B.
B. C.
C. D.
D.