题目内容
为测定某含有氧化铁、四氧化三铁和氧化亚铁的混合物的组成,现取2.9g该混合物与足量CO充分反应,测得生成铁的质量为2.1g,则混合物中氧化亚铁的质量可能为
| A.0.7g | B.1.1g | C.1.5g | D.1.9g |
A
试题分析:根据题意,氧化铁、四氧化三铁和氧化亚铁的混合物与足量的CO充分反应,生成铁和二氧化碳,结合质量守恒定律可知,混合物中的铁元素的质量和生成的铁的质量相等,故混合物中铁、氧元素的质量比=2.1g:(2.9g -2.1g)=21:8。
根据化学式的计算可知,
FeO中铁元素和氧元素的质量比=56:16=7:2=21:6;
Fe2O3中铁元素和氧元素的质量比=112:48=7:3=21:9;
Fe3O4中铁元素和氧元素的质量比=168:64=21:8;
由此可知,混合物中Fe3O4的质量可以为任意值,
设混合物中氧化亚铁的质量为x、氧化铁的质量为y,则混合物中铁元素与氧元素的质量比为(x×
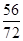 ×100%+y×
×100%+y×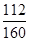 ×100% ):(x×
×100% ):(x×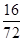 ×100%+y×
×100%+y×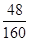 ×100% )=21:8,解得x:y=9:20,即混合物中氧化亚铁的质量不能大于0.9g,故选A。
×100% )=21:8,解得x:y=9:20,即混合物中氧化亚铁的质量不能大于0.9g,故选A。点评:本题考查学生根据质量分数与化合物中元素的质量比进行分析解题的能力,理解和熟记物质组成的综合计算方法,以及与之相关的知识,是解题的关键。

练习册系列答案
相关题目

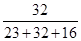 ×100%
×100%