题目内容
19、下图是实验室一瓶标签破损的无色透明液体,小意同学对该液体进行了如下的实验探究:
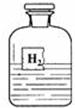
(1)若用玻璃棒蘸取少量液体滴在一张白纸上,发现白纸变黑,则该瓶
液体是
(2)某同学不慎将上述液体沾到衣服上,应立即
(3)将上述液体小心滴2滴到盛有氯化钡溶液的试管中,有

(1)若用玻璃棒蘸取少量液体滴在一张白纸上,发现白纸变黑,则该瓶
液体是
浓硫酸(或浓H2SO4)
.(2)某同学不慎将上述液体沾到衣服上,应立即
用大量的水冲洗
,然后涂上3%~5%的碳酸氢钠溶液.(3)将上述液体小心滴2滴到盛有氯化钡溶液的试管中,有
有白色沉淀生成,并有热量放出
现象,反应的化学方程式为H2SO4+BaCl2=BaSO4↓+2HCl
.分析:(1)浓硫酸具有极强的腐蚀性,能把纸张等有机物碳化;因此,把该液体滴在白纸上,发现白纸变黑,可依据标签中可见部分判断该液体为浓硫酸;
(2)为防止浓硫酸对衣服的腐蚀,当衣服上沾有浓硫酸时就用大量的水进行冲洗,然后使用呈弱碱性的3%~5%的碳酸氢钠溶液涂抹;
(3)浓硫酸溶解于水时会放出大量的热,而溶液中的硫酸根能与氯化钡溶液中的钡离子形成不溶于水也不溶于酸的硫酸钡的白色沉淀,同时生成HCl.
(2)为防止浓硫酸对衣服的腐蚀,当衣服上沾有浓硫酸时就用大量的水进行冲洗,然后使用呈弱碱性的3%~5%的碳酸氢钠溶液涂抹;
(3)浓硫酸溶解于水时会放出大量的热,而溶液中的硫酸根能与氯化钡溶液中的钡离子形成不溶于水也不溶于酸的硫酸钡的白色沉淀,同时生成HCl.
解答:解:(1)浓硫酸可把纸张中H、O元素以水的形式而脱去,使纸张碳化而变黑;因此,根据白纸变黑的现象及标签中可见部分,可判断该液体应为浓硫酸;
(2)如果不慎把浓硫酸沾到衣服上,应立即用大量水进行冲洗而除去,并涂抹呈弱碱性的3%~5%的碳酸氢钠溶液以中和剩余的硫酸;
(3)把浓硫酸滴入氯化钠溶液中时,浓硫酸溶于水时会放出大量热;且硫酸可与氯化钡发生反应生成不溶于水也不溶于酸的硫酸钡的白色沉淀;因此可观察到:生成白色沉淀,并伴有热量放出;反应的化学方程式为H2SO4+BaCl2=BaSO4↓+2HCl;
故答案为:(1)浓硫酸(或浓H2SO4);
(2)用大量的水冲洗;
(3)有白色沉淀生成,并有热量放出(没有写“放出热量”不扣分);H2SO4+BaCl2=BaSO4↓+2HCl.
(2)如果不慎把浓硫酸沾到衣服上,应立即用大量水进行冲洗而除去,并涂抹呈弱碱性的3%~5%的碳酸氢钠溶液以中和剩余的硫酸;
(3)把浓硫酸滴入氯化钠溶液中时,浓硫酸溶于水时会放出大量热;且硫酸可与氯化钡发生反应生成不溶于水也不溶于酸的硫酸钡的白色沉淀;因此可观察到:生成白色沉淀,并伴有热量放出;反应的化学方程式为H2SO4+BaCl2=BaSO4↓+2HCl;
故答案为:(1)浓硫酸(或浓H2SO4);
(2)用大量的水冲洗;
(3)有白色沉淀生成,并有热量放出(没有写“放出热量”不扣分);H2SO4+BaCl2=BaSO4↓+2HCl.
点评:根据浓硫酸能使纸碳化变黑的特点及标签可见部分的提示,推断该液体为浓硫酸是解答本题的基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?泉港区质检)化学兴趣小组为了探究化学实验室里一种黑色粉末和一瓶标签破损的无色溶液(如图所示)可能是什么物质,进行大胆猜想并设计实验验证.
(2009?泉港区质检)化学兴趣小组为了探究化学实验室里一种黑色粉末和一瓶标签破损的无色溶液(如图所示)可能是什么物质,进行大胆猜想并设计实验验证.
 下图是实验室一瓶标签破损的无色透明液体,小意同学对该液体进行了如下的实验探究:
下图是实验室一瓶标签破损的无色透明液体,小意同学对该液体进行了如下的实验探究: