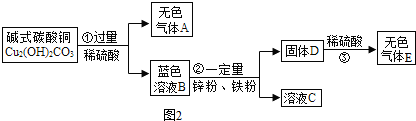
题目内容
根据4.6克某种纯净物完全燃烧,需要消耗9.6克氧气,生成8.8克二氧化碳和5.4克水的事实,可以判该物质中( )
| A、只含碳、氢两种元素 |
| B、只含碳、氢、氧三种元素 |
| C、只含碳元素 |
| D、可能含碳、氢、氧三种元素 |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:由“生成8.8g二氧化碳和5.4g水”,可知碳元素和氢元素的质量,它们的和与纯净物4.6g比较,则可知某纯净物中是否含有氧元素;
解答:解:因为8.8g二氧化碳中碳元素的质量为:8.8×
×100%=2.4克,5.4g水中氢元素的质量为:5.4×
×100%=0.6克,2.4+0.6=3.0克<4.6克,一定还含有氧元素,故该纯净物中含有碳、氢、氧三种元素.
答案:B
| 12 |
| 44 |
| 2 |
| 18 |
答案:B
点评:掌握质量守恒定律的内容及其应用,学会利用此“守恒”思想处理问题;掌握物质的元素组成.

练习册系列答案
相关题目
关于水和双氧水(H2O2)的说法不正确的是( )
| A、都含有氢元素和氧元素 |
| B、都能分解生成氧气 |
| C、化学性质都相同 |
| D、相对分子质量比为18:34 |
化学学习小组做实验时记录了下列实验现象,其中正确的是( )
| A、镁带在空气中燃烧时,发出耀眼的白光 |
| B、铁丝在空气中剧烈燃烧,火星四射 |
| C、在空气中加热铜片,铜片表面有黑色固体生成 |
| D、打开盛有浓硫酸的瓶盖后,瓶口出现白烟 |
建立宏观与微观的联系是化学独特的思维方式.下列有关说法中,叙述错误的是( )
| A、分子、原子和离子都能直接构成物质 |
| B、化学反应遵守质量守恒定律是因为反应前后原子的种类与数目都未发生改变 |
| C、中和反应的实质是酸中的氢离子与碱中的氢氧根离子结合成水 |
| D、向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,说明该溶液中一定存在SO42- |
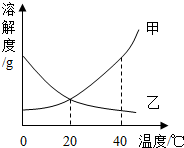 甲、乙两种固体的溶解度曲线如图所示,从中获取的信息正确的是( )
甲、乙两种固体的溶解度曲线如图所示,从中获取的信息正确的是( )| A、甲的溶解度大于乙的溶解度 |
| B、降低温度可使乙的不饱和溶液变为饱和溶液 |
| C、20℃时甲的饱和溶液升温至40℃,溶液中溶质的质 量分数增大 |
| D、20℃时甲、乙的饱和溶液中溶质的质量分数相等 |
在一密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:( )
| 物质 | X | Y | Z | Q |
| 反应前的质量(g) | 10 | 2 | 40 | 5 |
| 反应后的质量(g) | 待测 | 24 | 8 | 23 |
| A、该反应可能是化合反应 |
| B、Y、Q的相对分子质量比一定为11:9 |
| C、参加反应的X、Z的质量比是1:4 |
| D、反应后X的质量为8g |
下列说法中正确的是( )
| A、二氧化碳是由碳和氧气组成的 |
| B、混合物是由多种元素组成的 |
| C、水是由两个氢原子和一个氧原子构成的 |
| D、氮气、氧气属于单质,而氨气NH3属于化合物 |
下列操作中正确是( )
| A、为了加速过滤,用玻璃棒搅拌过滤器中的液体 |
| B、向燃着的酒精灯里添加酒精 |
| C、将胶头滴管伸进试管内滴加液体 |
| D、用10毫升的量筒量取8毫升水 |