��Ŀ����
����Ŀ����һ����������X����KOH��Na2SO4��CaCO3��BaCl2��Cu(NO3)2�е����ֻ��������ϻ�϶��ɡ�Ϊ̽����ɷ֣�ijѧϰС���������ʵ�飺
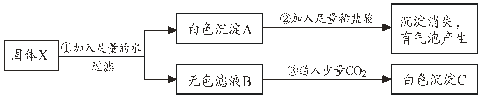
��1���Ӳ���ٵ�ʵ������֪������X��һ�������� ��
��2������ڷ�����Ӧ�Ļ�ѧ����ʽΪ ��
�˷�Ӧ������ ��
��3���Ӳ���۵�ʵ������֪����ɫ����CΪ ��
��4����������ʵ���ƶϹ���X�� ��ɣ���д��ѧʽ����
��5������ȥ��ʵ�鲽��ۣ����Ӳ���١��ڵ�ʵ�����ƶϣ�����X����ɿ����� �֡�
���𰸡���1��Cu(NO3)2 ��2��CaCO3+2HCl = CaCl2+CO2��+H2O ���ֽⷴӦ
��3��BaCO3 ��4��CaCO3��KOH��BaCl2 ��5��5
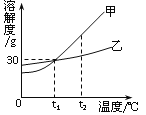
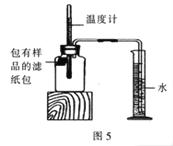
��������
�������������ͭ����Һ�г�����ɫ��̼���������ˮ��̼��ƺ����ᷴӦ���ɶ�����̼���壬���������Ͷ�����̼��Ӧ����̼��أ�̼������Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ع���1����Ϊ��ҺBΪ��ɫ������֪������X��һ������������ͭ����2��ͨ���Ƶ���֪����ڷ�����ӦΪ̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���䷴Ӧ�Ļ�ѧ����ʽΪCaCO3+2HCl = CaCl2+CO2��+H2O �����ݷ�Ӧ���ص�֪���� ���ֽⷴӦ����3���Ӳ���۵�ʵ������֪����ɫ����CΪ̼�ᱵ����4����������ʵ���ƶϹ���X��CaCO3 ��KOH��BaCl2����5������ȥ��ʵ�鲽��ۣ����Ӳ���١��ڵ�ʵ�����ƶϣ�����X����ɿ����Т�CaCO3��BaCl2����CaCO3 ��KOH��BaCl2����CaCO3 ��Na2SO4����CaCO3��Na2SO4 KOH ��CaCO3��KOH ���Կ�����5�ֿ��ܡ�