题目内容
已知碳在氧气中不完全燃烧可生成一氧化碳和二氧化碳,反应表示为:C+O2| 点燃 |
分析:根据质量守恒定律,可计算出生成的56g一氧化碳中碳的质量,然后可求出生成的二氧化碳中碳的质量,那么就求出生成的二氧化碳的质量,进而可求出参加反应的氧气的质量,根据参加反应的物质比例和生成物质比例就可以配平.
解答:解:56g一氧化碳中碳的质量=56×(
×100%)=24g,又根据碳元素质量守恒得:二氧化碳中碳的质量=72-24=48g,那么二氧化碳的质量=48÷(
×100%)=176g;生成物一氧化碳56g和二氧化碳176g总共是232g,那参加反应的碳是72g,氧气则为:232g-72g=160g,那么参加反应的碳、氧气和生成的一氧化碳、二氧化碳的质量之比=72:160:56:176;那么根据它们的质量比可以在每个化学式的前面配上合适的计量数满足其质量比例,即除以各自的相对分子质量或相对原子质量即为化学计量数.
故正确答案:6C+5O2
2CO+4CO2
| 12 |
| 28 |
| 12 |
| 44 |
故正确答案:6C+5O2
| ||
点评:本题是考查利用质量守恒定律来配平一些给予信息的化学方程式,只要写求出每种元素的质量后再求出参加反应的物质质量和生成的物质的质量,根据它们的质量比例配平后再约分即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
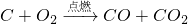 ,若72g碳不完全燃烧生成了56g一氧化碳和一定质量的二氧化碳,
,若72g碳不完全燃烧生成了56g一氧化碳和一定质量的二氧化碳,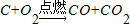 ,若72g碳不完全燃烧生成了56g一氧化碳和一定质量的二氧化碳,请你通过计算写出符合该实验事实的化学反应方程式(要配平):.
,若72g碳不完全燃烧生成了56g一氧化碳和一定质量的二氧化碳,请你通过计算写出符合该实验事实的化学反应方程式(要配平):.