题目内容
已知某+3价金属氧化物中氧元素的质量分数为30%,该金属的相对原子质量为( )A.40
B.64
C.56
D.127
【答案】分析:先依据金属元素和氧元素的化合价写出该金属氧化物的化学式,再设该金属的相对原子质量为x,最后根据氧元素的质量分数为30%,即可算出该金属的相对原子质量.
解答:解:设该金属元素为R,因为该金属元素在其氧化物中显示+3价,则其氧化物的化学式为:R2O3;
设R的相对原子质量为x,则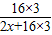 ×100%=30%,解得x=56;
×100%=30%,解得x=56;
故选C.
点评:主要考查了元素质量分数的计算方法;某元素的质量分数= ×100%.
×100%.
解答:解:设该金属元素为R,因为该金属元素在其氧化物中显示+3价,则其氧化物的化学式为:R2O3;
设R的相对原子质量为x,则
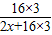 ×100%=30%,解得x=56;
×100%=30%,解得x=56;故选C.
点评:主要考查了元素质量分数的计算方法;某元素的质量分数=
 ×100%.
×100%. 
练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
金属材料在人类活动中已得到越来越广泛的应用.
(1)下列有关金属锈蚀与保护措施中不正确的是______
A 铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学变化
B 同样的铁制品在海南比在兰州更易锈蚀
C 在铁制品表面刷油漆可以防止铁锈蚀
D 铝的抗腐蚀性能比铁强,生活中用钢丝球洗刷铝锅
(2)镉是人体非必需元素,当环境受到镉污染后,镉可引起慢性中毒.已知:镉(Cd)是一种银白色金属,在化合物中通常表现为+2价;水体中镉元素通常以氯化镉的形式存在;氯化镉能溶于水,氢氧化镉难溶于水.
①写出金属镉或其某种化合物的一种物理性质______.
②金属镉与铜、银活动性顺序的探究
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量镉、铜、银于试管中,加入足量盐酸 | 镉表面有气泡产生,铜、银表面无气泡产生 | ______ |
| 取适量铜于试管中,加入少量硝酸银溶液 | ______ | 铜的活动性顺序大于银 |
(3)某含杂锌粉5.0克,放入50克盐酸中(杂质不与盐酸反应),恰好完全反应,此时烧杯内各物质的总质量为54.9克.计算:所用盐酸的溶质质量分数.