题目内容
【题目】写出相应的化学符号。
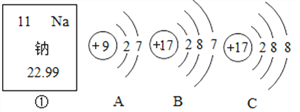
(1)常温下的液态金属是______________;(2)+3价的铝元素______________;
(3)4个铵根离子____________________;(4)硝酸钾_________________。
【答案】 Hg ![]() 4NH4+ KNO3
4NH4+ KNO3
【解析】本题考查了常见的化学用语的书写。书写时注意规范。
(1)常温下的液态金属是汞,化学式是Hg;
(2)化合价的表示方法是在该元素的上方用正负号和数字表示,正负号在前,数字在后,+3价的铝元素表示为![]() ;
;
(3)离子的表示方法是在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。表示多个该离子,就在其元素符号前加上相应的数字;4个铵根离子可表示为4NH4+;
(4)硝酸钾中钾元素呈+1价,硝酸根呈-1价,硝酸钾的化学式可表示为:KNO3。

【题目】下表为氯化铵和氯化钠在不同温度时的溶解度。下列说法正确的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl 溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl 溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
A. 20 ℃,氯化钠饱和溶液的溶质质量分数为36%
B. 由表中数据可知,溶解度受温度变化影响较大的物质是氯化钠
C. 氯化钠与氯化铵溶解度相等的温度在10 ℃~20 ℃之间
D. 50 ℃时,100 g水中加入50.0 g氯化铵配成溶液,再冷却到20 ℃,能够析出13.2 g固体
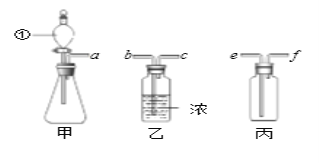
【题目】某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。
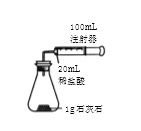
开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____