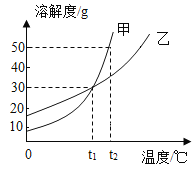
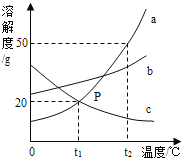
题目内容
【题目】学习碱的个性时,同学们在实验室中做“检测氢氧化钙性质”的实验,实验方案如图所示(说明:实验中使用的药品均为溶液)。请回答下列问题:

(1)写出盐酸加入氢氧化钙中反应的化学方程式: ;在实验过程中,并没有观察到该反应的明显现象,请你写出一种能观察到变化发生的方法: 。
(2)实验结束后,同学们将四支试管中的物质全部倒入废液缸中。为了处理废液废渣,首先对废液缸中物质的成分进行初步分析,过程如下图所示:

由上述分析可知:
①固体A中一定含有碳酸钙和 。
②无色溶液B中使酚酞变红的物质是 。
【答案】⑴Ca(OH)2+2HCl=CaCl2+2H2O;先往氢氧化钙中滴入1~2滴无色酚酞试液(或紫色石蕊试液) ⑵①氢氧化铁[或Fe(OH)3] ②一定有碳酸钠,可能有氢氧化钠
【解析】⑴盐酸能与氢氧化钙发生中和反应生成氯化钙和水,该反应过程无明显现象发生,可借助指示剂(无色酚酞试液或紫色石蕊试液);⑵向无色溶液B中加入无色酚酞试液后变为红色,说明溶液B显碱性,根据题中提供的药品可以推断出能与盐酸反应产生无色气体的一定是可溶性的碳酸盐,则红色溶液C中一定含有碳酸钠,可能含有碳酸钠与氢氧化钙反应产生的氢氧化钠,则C溶液中一定不含钙离子,故红褐色固体A中一定含有碳酸钙和氢氧化铁。

【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研究性学习小组的同学在老师的指导下对该产品开展了以下探究活动.

【查阅资料】
“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为122),它是一种白色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物质,是当前使用最为广泛的洗涤助剂之一.
【实验探究一】过碳酸钠的化学组成
为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
① | 向盛有过碳酸钠固体的试管中加入适量水 | 固体溶解 | . |
② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡产生 | |
③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是 ;过碳酸钠溶于水能生成 (填化学式). |
④ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色沉淀 | 反应的化学方程式 . |
实验 小结 | 过碳酸钠的化学式是 ; 过碳酸钠与水反应的化学方程式是 . | ||
【实验探究二】:过碳酸钠含量测定
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定该样品中过碳酸钠的含量,同学们经讨论设计了如图所示的实验装置.图中装置B盛装氢氧化钠溶液、C盛装澄清石灰水、D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气).
(1)首先关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置B的作用是 ;
(2)依次关闭活塞K1、K3、K4,打开活塞K2、K,此时锥形瓶中反应生成的气体是 ,E中装入碱石灰的作用是 ,反应完全后关闭活塞K,再次打开活塞K1通入氮气的作用是 ;
(3)同学们根据E装置在测定前后的质量差计算出了样品中过碳酸钠的含量.装置F的作用是 ,如不连接装置F,测定的过碳酸钠含量会 (填“偏高”或“偏低”).