题目内容
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
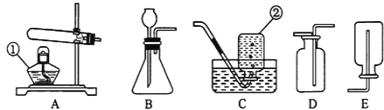
氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:


(1)装置B的作用是 ;装置D的作用是 ;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成.
①写出CaH2与水反应的化学方程式 ;
②该同学的判断不正确,原因是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,方法为 ;
②装入药品,按图2(固定装置省略)所示连接仪器。
③调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
④将Y型管中水与氢化钙样品混合,操作为 。
⑤反应结束,冷却至室温,再次 ,读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为 。(结果精确到0.1%)(2分)
(8)结果讨论:(填“偏大” 、“偏小” 、“准确”)
①Y型管中残留有氢气,对测定结果的影响是 。
②未冷却至室温即读数,对测定结果的影响是 。
【答案】(1)装置B吸收水蒸汽和氯化氢气体;防止空气中的水进入C装置;
(2)②①④③ (3)①化学方程式略; ②钙也能与水反应生成氢氧化钙,能使酚酞变红。
【产品的定量测定】
①略;④将Y形管慢慢倾斜,直至A中的水与B中样品相混合;
⑤调节量气管与水准管液面相平;
(5)量气管中液面不再变化。(6)100.0mL。
(7)88.4%。(结果精确到0.1%)
(8)①准确。 ②偏大。
【解析】
试题分析:(1)装置B碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;装置D为浓硫酸具有吸水性作为干燥剂,防止空气中的水进入C装置;
(2)氢气不纯加热易爆炸,且容器内的空气也会对反应造成干扰,因此先让产生的氢气排净空气后,再加热让氢气和钙反应,待反应完全后也必需保证产物在氢气的氛围内冷却,因此顺序为②①④③;
(3)①钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H2 CaH2;②钙也能与水反应生成氢氧化钙,能使酚酞变红;
【产品的定量测定】
①从气压上考虑是否有泄漏,用手心握住Y管,若量气管内的水排入水准管,那么气密性好;
④即将反应物混合,可以将Y形管慢慢倾斜,直至A中的水与B中样品相混合;
⑤为使容器内气压等于外界大气压以得到准确的数据,需再次调节量气管与水准管液面相平,然后读数;
(5)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(6)氢气的体积等于反应前后液面差,为:110.0mL-10.0mL=100.0mL;
(7)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg-X,钙与水反应生成氢气质量为9mg-Y则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
42/X=4/Y 解得Y=2X/21
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-X 9mg-Y
40/(100mgX)=2/(9mgY)
将Y=2X/21代入,解得X=88.4mg
所以样品中氢化钙的纯度为:88.4mg/100mg×100%=88.4%;
(8)①不会影响容器气压的增大量,对氢气体积的测量结果无影响,因此准确;
②会使氢气的体积读数大于实际,即氢气的测量结果偏大,那么会使计算结果偏大。