题目内容
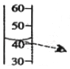
【题目】固体氢氧化钠放置在空气中容易变质转化为碳酸钠.现称取一久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为8.55%的氢氧化钡溶液,产生沉淀与所加氢氧化钡溶液的质量关系如图所示.请通过计算回答:
(1)该烧碱样品变质的程度为(填“部分变质”或“全部变质”).
(2)a=g.
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)
【答案】
(1)全部变质
(2)200
(3)
解:设参加反应的碳酸钠的质量为x,参加反应的氢氧化钡的质量为y,生成氢氧化钠的质量为z
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
171 106 197 80
y x 19.7g z
![]()
x=10.6g
y=17.1g
z=8g
溶液中溶质NaOH的质量分数为 ![]() ×100%=2.85%.
×100%=2.85%.
答:溶液中溶质NaOH的质量分数为2.85%.
【解析】设参加反应的碳酸钠的质量为x,参加反应的氢氧化钡的质量为y,生成氢氧化钠的质量为z
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
171 106 197 80
y x 19.7g z![]() =
=![]() =
=![]() =
=![]()
x=10.6g,
y=17.1g,
z=8g,
(1)所以该烧碱样品变质的程度为全部变质;(2)a=![]() =200g;(3)溶液中溶质NaOH的质量分数为
=200g;(3)溶液中溶质NaOH的质量分数为![]() ×100%=2.85%.
×100%=2.85%.
所以答案是:(1)全部变质;(2)200;(3)溶液中溶质NaOH的质量分数为2.85%.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目