题目内容
(2013?启东市一模)(1)如图是实验室制取二氧化碳并验证其性质的装置图,回答:
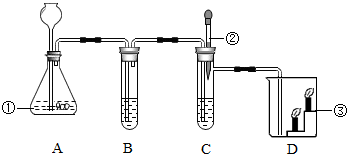
①A是实验室制取二氧化碳的装置,内装药品为
②B的试管中装有滴有紫色石蕊的蒸馏水,现象为
③装置C中有澄清石灰水,其中发生化学反应的化学方程式为
④装置D中有两支高低不同的燃着的蜡烛,可观察低处的蜡烛先灭,高处的蜡烛后灭,说明二氧化碳具有
(2)实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)2]中的一种.请你完成以下探究:
[猜 想]猜想A:该化肥是NH4Cl,猜想B:该化肥是(NH4)2SO4,猜想C:该化肥是NH4HCO3,猜想D:该化肥是尿素.
[实验探究]
(Ⅰ)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想
(Ⅱ)如图(甲),分别取少量样品于试管中,滴加适量水振荡,再选(乙)中
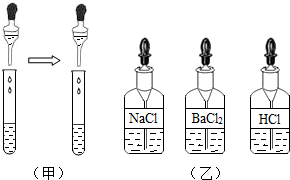
(Ⅲ)在步骤(Ⅱ)的试管中再滴入(乙)中的

①A是实验室制取二氧化碳的装置,内装药品为
大理石、稀盐酸
大理石、稀盐酸
;②B的试管中装有滴有紫色石蕊的蒸馏水,现象为
紫色石蕊试液变红
紫色石蕊试液变红
;③装置C中有澄清石灰水,其中发生化学反应的化学方程式为
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
;④装置D中有两支高低不同的燃着的蜡烛,可观察低处的蜡烛先灭,高处的蜡烛后灭,说明二氧化碳具有
密度比空气大,一般不能燃烧也不能支持燃烧
密度比空气大,一般不能燃烧也不能支持燃烧
性质.(2)实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)2]中的一种.请你完成以下探究:
[猜 想]猜想A:该化肥是NH4Cl,猜想B:该化肥是(NH4)2SO4,猜想C:该化肥是NH4HCO3,猜想D:该化肥是尿素.
[实验探究]
(Ⅰ)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想
D
D
不成立.(Ⅱ)如图(甲),分别取少量样品于试管中,滴加适量水振荡,再选(乙)中
HCl
HCl
溶液滴入试管中,若无气泡放出,则猜想C
C
不成立.
(Ⅲ)在步骤(Ⅱ)的试管中再滴入(乙)中的
BaCl2
BaCl2
溶液,若无白色沉淀
无白色沉淀
,则猜想A成立;若有白色沉淀
有白色沉淀
,则猜想B成立,其反应的化学方程式为:BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl
BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl
.(注:乙图中药品为食盐、氯化钡、盐酸三种溶液)分析:(1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.二氧化碳的化学性质有:既不能燃烧也不能支持燃烧,也不供给呼吸;能与水反应生成碳酸,碳酸能使紫色石蕊试液变红色;能使澄清的石灰水变浑浊,是因为二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.(2)铵根离子一般用碱来检验,铵态氮肥遇到碱性物质会放出氨气,而尿素不是铵态氮肥,因此不会放出氨气;分别取少量样品于试管中,滴加适量水振荡,再选稀盐酸滴入,若无气泡放出,则不是碳酸氢铵;在步骤(Ⅱ)的试管中再滴入(乙)中的氯化钡溶液,若无白色沉淀,该化肥是NH4Cl;若有白色沉淀,该化肥是(NH4)2SO4;氯化钡和硫酸铵反应生成硫酸钡白色沉淀和氯化铵,配平即可.
解答:解:(1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的化学性质有:既不能燃烧也不能支持燃烧,也不供给呼吸;能与水反应生成碳酸,碳酸能使紫色石蕊试液变红色;能使澄清的石灰水变浑浊,是因为二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水;故答案为:①大理石、稀盐酸 ②紫色石蕊试液变红 ③CO2+Ca(OH)2=CaCO3↓+H2O;④密度比空气大,一般不能燃烧也不能支持燃烧
(2)铵根离子一般用碱来检验,铵态氮肥遇到碱性物质会放出氨气,而尿素不是铵态氮肥,因此不会放出氨气;分别取少量样品于试管中,滴加适量水振荡,再选稀盐酸滴入,若无气泡放出,则不是碳酸氢铵;在步骤(Ⅱ)的试管中再滴入(乙)中的氯化钡溶液,若无白色沉淀,该化肥是NH4Cl;若有白色沉淀,该化肥是(NH4)2SO4;氯化钡和硫酸铵反应生成硫酸钡白色沉淀和氯化铵,配平即可;故答案为:(Ⅰ)D;(Ⅱ) HCl;C;(Ⅲ) BaCl2;无白色沉淀;有白色沉淀; BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl
(2)铵根离子一般用碱来检验,铵态氮肥遇到碱性物质会放出氨气,而尿素不是铵态氮肥,因此不会放出氨气;分别取少量样品于试管中,滴加适量水振荡,再选稀盐酸滴入,若无气泡放出,则不是碳酸氢铵;在步骤(Ⅱ)的试管中再滴入(乙)中的氯化钡溶液,若无白色沉淀,该化肥是NH4Cl;若有白色沉淀,该化肥是(NH4)2SO4;氯化钡和硫酸铵反应生成硫酸钡白色沉淀和氯化铵,配平即可;故答案为:(Ⅰ)D;(Ⅱ) HCl;C;(Ⅲ) BaCl2;无白色沉淀;有白色沉淀; BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl
点评:本考点主要考查了二氧化碳的制取和性质,同时也考查了化学方程式的书写和物质的推断,综合性比较强.二氧化碳的化学性质要记牢,要会检验铵根离子和硫酸根离子等.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
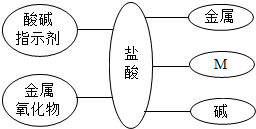 (2013?启东市一模)(1)构建知识网络,可以帮助我们理解知识间的内 在联系.如图是盐酸与不同类别物质反应的知识网络.
(2013?启东市一模)(1)构建知识网络,可以帮助我们理解知识间的内 在联系.如图是盐酸与不同类别物质反应的知识网络.