题目内容
【题目】向盛有26.4g硫酸钠和碳酸钠混合物的烧杯中加入218g稀硫酸,恰好完全反应,固体全部消失,反应后所得溶液总质量为240g.请计算:
(1)原混合物中碳酸钠的质量.
(2)反应后所得溶液中溶质的质量分数(写出计算过程)
【答案】
(1)解:烧杯内物质总质量减少了26.4g+218g﹣240g=4.4g,说明碳酸钠和稀硫酸反应生成了4.4g二氧化碳,
设碳酸钠质量为x,反应生成硫酸钠质量为y,
Na2CO3+H2SO4═ | Na2SO4+H2O+ | CO2↑, |
106 | 142 | 44 |
x | y | 4.4g |
![]() ,
,
x=10.6g,y=14.2g,
答:原混合物中碳酸钠的质量是10.6g.
(2)解:反应后所得溶液中溶质的质量分数为: ![]() ×100%=12.5%,
×100%=12.5%,
答:反应后所得溶液中溶质的质量分数为12.5%.
【解析】烧杯内物质总质量减少了26.4g+218g﹣240g=4.4g,说明碳酸钠和稀硫酸反应生成了4.4g二氧化碳,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.

【题目】根据如表回答问题 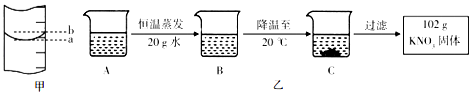
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,溶解度最大的物质是 .
(2)60℃时,100g水中最多溶解NaClg.
(3)量筒的局部示意图如图甲所示,量取时应沿(选填“a”或“b”)视线进行读数.
(4)A是80℃含有120g水的KNO3溶液.经过图乙操作,得到102g KNO3固体. ①A溶液为(选填“饱和”或“不饱和”)溶液;
②对以上过程的分析,正确的是(选填字母).
a.A到B的过程中,溶液中溶质的质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等于222g
d.开始析出KNO3固体的温度在60℃至80℃之间.
