题目内容
【题目】某化学兴趣小组学习碱的性质后,通过实验对氢氧化碳的化学性质进行了验证和总结,请根据如图,回答问题。

(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得到结论,氢氧化钙溶液呈__________(填“酸性”、“碱性”或“中性”);
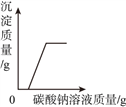
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到的现象是__________,此时所得溶液中含有的溶质有酚酞和__________;加入过量的__________除去盐酸,得到只含一种溶质的溶液。
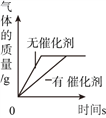
(3)丙同学根据图见能与部分非金属氧化物反应,得出结论:实验室存放碱溶液时需__________;
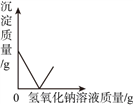
(4)丁同学将碳酸钠溶液加入滴有酚酞的氢氧化钙溶液中,充分反应后,观察到的现象__________;反应后溶液中的溶质一定含有的溶质和酚酞和__________,可能含有的溶质是__________(写出一种可能即可),请设计实验验证你的猜测__________。
【答案】 碱性 溶液由红无色变为无色 HCl和CaCl2 石灰石(大理石) 密封保存 溶液颜色不变,有白色沉淀生成 NaOH Na2CO3 取上层清液,加入氢氧化钙溶液,有白色沉淀生成,则含有Na2CO3(或Ca(OH)2;取上层清液,加入碳酸钠溶液,有白色沉淀生成,则含有Ca(OH)2)
【解析】(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈碱性;
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,氢氧化钙和稀盐酸反应生成氯化钙和水,溶液显酸性,因此观察到的现象是溶液由红色变成无色;
此时所得溶液中含有的溶质有酚酞和HCl、CaCl2;
加入过量的碳酸钙能够除去盐酸,得到只含有一种溶质氯化钙的溶液;
(3)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,实验室存放碱溶液时需密封保存;
(4)丁同学将碳酸钠溶液加入滴有酚酞的氢氧化钙溶液中,碳酸钠和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠,充分反应后溶液显碱性,观察到的现象是溶液颜色不变,产生白色沉淀;
反应后溶液中的溶质一定含有的溶质是酚酞和氢氧化钠,可能含有的溶质是碳酸钠或氢氧化钙;
验证猜想的实验方案是:实验步骤:取上层清液少量于试管中,滴加碳酸钠溶液;
实验现象及其实验结论:如果无明显现象,说明溶液中可能含有碳酸钠;
如果产生白色沉淀,说明溶液中含有氢氧化钙。

 阅读快车系列答案
阅读快车系列答案【题目】(5分)粗盐中含泥沙、氯化钙、氯化镁等杂质,某同学自制的简易净水器(如图1)中放置物质的顺序错误,使净水效果不理想。

(1)请按由上到下的顺序重新排列 (填字母).调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
(2)如图2中步骤①②都需要进行 操作,步骤④需要进行 操作;
(3)已知试剂X是碱溶液,则沉淀Ⅰ为 (写化学式),下列碱溶液不符合要求的是_________(填序号)。
A.氢氧化钠溶液 | B.氢氧化钡溶液 | C.氢氧化钾溶液 | D.氢氧化钙溶液 |
(4)步骤②除去氯化钙的反应方程式是 ;步骤③中发生中和反应的化学方程式是 。