题目内容
【题目】A、B、C三种固体物质在水中的溶解度曲线如右图所示,请回答:

(1) ℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;
(2)若B中混有少量的A,最好采用 的方法提纯B;
(3)现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③ ;
(4)t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是 ;
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是 。
【答案】(1)t2(2)蒸发结晶(或蒸发溶剂)(3)升高温度(4)20﹪(5)C>B>A(或CBA)
【解析】试题分析:(1)A、B两种物质在100g水中达到饱和状态时溶解的质量相等,应该为溶解度曲线的交叉点;故温度为t2;
(2)因为A物质的溶解度受温度的影响较大,得到B物质应该采用蒸发溶剂法;
(3)根据C物质的溶解度随温度的升高而减小,故接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③为升高温度;
(4)根据A物质的在t3℃时的溶解度数值可知,50g水中最多能溶解12.5g故溶液中溶质的质量分数为12.5/62.5×100%=20%;
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是C>B>A。

【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
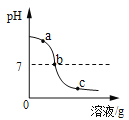
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。