题目内容
(6分)用化学方程式表示:
(1)用稀盐酸除去小刀上的铁锈:_____ 。
(2)有非金属单质参加的置换反应: 。
(3)有非金属单质生成的反应: 。
(1)用稀盐酸除去小刀上的铁锈:_____ 。
(2)有非金属单质参加的置换反应: 。
(3)有非金属单质生成的反应: 。
(6分)(1)Fe2O3 + 6HCl = 2FeCl3 + 3H2O
(2)C + 2CuO 2Cu + CO2↑ 或 C + CuO
2Cu + CO2↑ 或 C + CuO  Cu + CO↑(标加热条件也给分)或 H2 + CuO
Cu + CO↑(标加热条件也给分)或 H2 + CuO  Cu + H2O (合理答案均可)
Cu + H2O (合理答案均可)
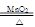 (3)2KClO3 2KCl + 3O2↑ 或 Zn + 2HCl = ZnCl2 + H2↑(合理答案均可)
(3)2KClO3 2KCl + 3O2↑ 或 Zn + 2HCl = ZnCl2 + H2↑(合理答案均可)
(2)C + 2CuO
 2Cu + CO2↑ 或 C + CuO
2Cu + CO2↑ 或 C + CuO  Cu + CO↑(标加热条件也给分)或 H2 + CuO
Cu + CO↑(标加热条件也给分)或 H2 + CuO  Cu + H2O (合理答案均可)
Cu + H2O (合理答案均可)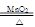 (3)2KClO3 2KCl + 3O2↑ 或 Zn + 2HCl = ZnCl2 + H2↑(合理答案均可)
(3)2KClO3 2KCl + 3O2↑ 或 Zn + 2HCl = ZnCl2 + H2↑(合理答案均可)考点:
专题:开放性简答题;物质的性质与用途.
分析:(1)首先要知道铁锈的主要成分是(Fe2O3),
(2)首先要知道置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应.在初中化学中学到的有非金属单质参加的置换反应主要是碳单质(C)和氢气(H2)的置换反应.
(3)在初中化学中学到的非金属单质中有实验室制法的主要有氧气的实验室制法和氢气的实验室制法.
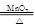 解答:解:(1)首先要知道铁锈的主要成分是(Fe2O3),根据酸的性质可知:酸和金属氧化物反应生成盐和水,那么盐酸和Fe2O3反应生成盐(FeCl3)和水(H2O),正确写出反应物、生成物的化学式,再根据质量守恒定律将化学方程式配平可得:Fe2O3+6HCl═2FeCl3+3H2O.
解答:解:(1)首先要知道铁锈的主要成分是(Fe2O3),根据酸的性质可知:酸和金属氧化物反应生成盐和水,那么盐酸和Fe2O3反应生成盐(FeCl3)和水(H2O),正确写出反应物、生成物的化学式,再根据质量守恒定律将化学方程式配平可得:Fe2O3+6HCl═2FeCl3+3H2O.
(2)解答这个问题学生可以回忆在课本中学到的置换反应,从中不难找到有非金属单质参加的置换反应:C+2CuO 2Cu+CO2↑或C+CuO
2Cu+CO2↑或C+CuO Cu+CO↑或 H2+CuO?Cu+H2O.
Cu+CO↑或 H2+CuO?Cu+H2O.
(3)氧气的实验室制法和氢气的实验室制法,都是有非金属单质生成的反应:
2KClO3 2KCl+3O2↑或Zn+H2SO4═ZnSO4+H2↑.
点评:本题重点(1)考查酸和金属氧化物的反应,铁锈的主要成分,(2)置换反应,(3)非金属单质的实验室制法.学生在平时的学习中要注意归纳总结基本反应类型之间的联系和区别,加强对物质实验室制法的学习总结.
专题:开放性简答题;物质的性质与用途.
分析:(1)首先要知道铁锈的主要成分是(Fe2O3),
(2)首先要知道置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应.在初中化学中学到的有非金属单质参加的置换反应主要是碳单质(C)和氢气(H2)的置换反应.
(3)在初中化学中学到的非金属单质中有实验室制法的主要有氧气的实验室制法和氢气的实验室制法.
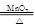 解答:解:(1)首先要知道铁锈的主要成分是(Fe2O3),根据酸的性质可知:酸和金属氧化物反应生成盐和水,那么盐酸和Fe2O3反应生成盐(FeCl3)和水(H2O),正确写出反应物、生成物的化学式,再根据质量守恒定律将化学方程式配平可得:Fe2O3+6HCl═2FeCl3+3H2O.
解答:解:(1)首先要知道铁锈的主要成分是(Fe2O3),根据酸的性质可知:酸和金属氧化物反应生成盐和水,那么盐酸和Fe2O3反应生成盐(FeCl3)和水(H2O),正确写出反应物、生成物的化学式,再根据质量守恒定律将化学方程式配平可得:Fe2O3+6HCl═2FeCl3+3H2O.(2)解答这个问题学生可以回忆在课本中学到的置换反应,从中不难找到有非金属单质参加的置换反应:C+2CuO
 2Cu+CO2↑或C+CuO
2Cu+CO2↑或C+CuO Cu+CO↑或 H2+CuO?Cu+H2O.
Cu+CO↑或 H2+CuO?Cu+H2O.(3)氧气的实验室制法和氢气的实验室制法,都是有非金属单质生成的反应:
2KClO3 2KCl+3O2↑或Zn+H2SO4═ZnSO4+H2↑.
点评:本题重点(1)考查酸和金属氧化物的反应,铁锈的主要成分,(2)置换反应,(3)非金属单质的实验室制法.学生在平时的学习中要注意归纳总结基本反应类型之间的联系和区别,加强对物质实验室制法的学习总结.

练习册系列答案
相关题目
 ”和“
”和“ ”表示两种不同原子。
”表示两种不同原子。