题目内容
一瓶无色液体A,含有NaCl、NaOH和Na2CO3中的两种;一包白色粉末B,含有CaO、Ca(OH)2和CaCO3中的两种.化学小组的同学决定探究A和B的成分.
【查阅资料】
①氯化钙溶液呈中性,碳酸钠溶液呈碱性;
②CaCl2+Na2CO3CaCO3↓+2NaCl;
③Ca(OH)2溶于水时无明显的温度变化.
【实验过程】同学们设计了如下图所示的实验方案,请根据图示过程回答问题.
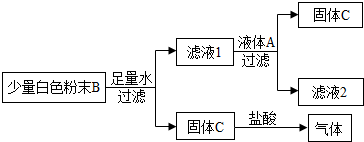
(1)固体C为______,写出滤液1与液体A之间发生反应的化学方程式______.
(2)液体A中一定含有______,白色粉末B中一定含有______.
(3)若液体A滴加适量,则滤液2中的溶质组成可能为______.
【继续探究】
(4)对白色粉末B的成分作出进一步的判断,最简单的方法是______.
(5)对无色液体A的成分作出进一步的判断,其实验方案是______.
解:
碳酸钙难溶于水,所以固体B中一定存在碳酸钙,固体C就是碳酸钙,滤液1中就只有氢氧化钙,液体A会与氢氧化钙生成碳酸钙,所以液体A中一定存在碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滤液2中含有氢氧化钠,无色液体A中含有两种物质,可能是碳酸钠和氢氧化钠,也可能是碳酸钠和氯化钠,所以滤液2中的溶质也有两种,只有氢氧化钠或者氢氧化钠和氯化钠.
氧化钙与水反应会放热,要鉴别白色粉末B的成分,只要加水通过温度的变化进行判断.
加氯化钙和碳酸钠反应后再加酚酞,只要溶液变红说明存在氢氧化钠,溶液不变色,说明存在氯化钠
故答案为:
(1)CaCO3;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(2)Na2CO3;CaCO3
(3)NaOH或NaOH和NaCl
(4)取B放入水中,看是否放热
(5)取少量A溶液于试管中,加入足量(或过量)氯化钙溶液,过滤,向滤液中滴加几滴无色酚酞溶液,若溶液变红,溶液A中含有NaOH和Na2CO3,若溶液不变色,溶液A中含有NaCl、Na2CO3.
分析:根据碳酸钙难溶于水,所以固体B中一定存在碳酸钙,固体C就是碳酸钙,滤液1中就只有氢氧化钙,液体A会与氢氧化钙生成碳酸钙,所以液体A中一定存在碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滤液2中含有氢氧化钠,无色液体A中含有两种物质,可能是碳酸钠和氢氧化钠,也可能是碳酸钠和氯化钠,所以滤液2中的溶质也有两种,只有氢氧化钠或者氢氧化钠和氯化钠.
据氧化钙与水反应会放热,要鉴别白色粉末B的成分,只要加水通过温度的变化进行判断,
将碳酸钠沉淀后检验溶液的酸碱性就可以判断氢氧化钠或氯化钠的存在,
点评:在解此类题时,先根据题中的现象推出可以确定存在或不存在的物质,对于现象不能确定的,需要再设计实验验证.
碳酸钙难溶于水,所以固体B中一定存在碳酸钙,固体C就是碳酸钙,滤液1中就只有氢氧化钙,液体A会与氢氧化钙生成碳酸钙,所以液体A中一定存在碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滤液2中含有氢氧化钠,无色液体A中含有两种物质,可能是碳酸钠和氢氧化钠,也可能是碳酸钠和氯化钠,所以滤液2中的溶质也有两种,只有氢氧化钠或者氢氧化钠和氯化钠.
氧化钙与水反应会放热,要鉴别白色粉末B的成分,只要加水通过温度的变化进行判断.
加氯化钙和碳酸钠反应后再加酚酞,只要溶液变红说明存在氢氧化钠,溶液不变色,说明存在氯化钠
故答案为:
(1)CaCO3;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(2)Na2CO3;CaCO3
(3)NaOH或NaOH和NaCl
(4)取B放入水中,看是否放热
(5)取少量A溶液于试管中,加入足量(或过量)氯化钙溶液,过滤,向滤液中滴加几滴无色酚酞溶液,若溶液变红,溶液A中含有NaOH和Na2CO3,若溶液不变色,溶液A中含有NaCl、Na2CO3.
分析:根据碳酸钙难溶于水,所以固体B中一定存在碳酸钙,固体C就是碳酸钙,滤液1中就只有氢氧化钙,液体A会与氢氧化钙生成碳酸钙,所以液体A中一定存在碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滤液2中含有氢氧化钠,无色液体A中含有两种物质,可能是碳酸钠和氢氧化钠,也可能是碳酸钠和氯化钠,所以滤液2中的溶质也有两种,只有氢氧化钠或者氢氧化钠和氯化钠.
据氧化钙与水反应会放热,要鉴别白色粉末B的成分,只要加水通过温度的变化进行判断,
将碳酸钠沉淀后检验溶液的酸碱性就可以判断氢氧化钠或氯化钠的存在,
点评:在解此类题时,先根据题中的现象推出可以确定存在或不存在的物质,对于现象不能确定的,需要再设计实验验证.

练习册系列答案
相关题目




